Органічні речовини в живій природі. Рівні структурної організації органічних речовин
УРОК 5
Тема. Органічні речовини в живій природі. Рівні структурної організації органічних речовин
Цілі: закріпити знання учнів про органічні речовини в живій природі – білки, жири, вуглеводи, нуклеїнові кислоти, їх склад, властивості; з’ясувати рівні структурної організації органічних речовин, їх характеристику.
Обладнання: мультимедійний проектор, роздавальний матеріал на картках, додаткова література.
Тип уроку: З(РДН).
Форми проведення: “Пошук інформації”, робота в групах, міні-тест, взаємоперевірка.
ХІД
I. Організація класу
II. Оголошення теми й мети уроку
III. Актуалізація опорних знань
Учитель. Давайте згадаємо, які органічні речовини входять до складу живих організмів. Основні з них – це білки, жири, вуглеводи та нуклеїнові кислоти.
IV. Інтерактивний метод
“Пошук інформації”, робота в групах
Об’єднуємо клас у шість груп, які отримують завдання – опрацювати матеріал про основні органічні речовини живих організмів.
Для кожної групи розробляються питання, відповіді на які можна знайти в різних джерелах інформації. Групам виділяється певний час на пошук та обговорення
I група – експертна (складається із сильних учнів, які отримали інформацію до уроку заздалегідь і будуть доповнювати результати роботи груп).
II група – опрацьовує матеріал про білки.
III група – опрацьовує матеріал про жири.
IV група – опрацьовує матеріал про вуглеводи.
V група – опрацьовує матеріал про нуклеїнові кислоти.
VI група – опрацьовує матеріал про рівні структурної організації живих організмів.
Роздавальний матеріал групам
І. Білки
1) Як побудовані білкові молекули?
2) Які властивості мають білки?
3) Яка біологічна роль білків?
Білки – біологічні полімери, мономерами яких є амінокислоти.
До складу білків входять залишки близько двадцяти видів амінокислот. Амінокислоти являють собою органічні молекули, які мають такий загальний план будови: вони містять карбоксильну групу – СООН й аміногрупу – NH2, пов’язані з атомом Карбону. Індивідуальні властивості кожної амінокислоти визначаються радикалом R.
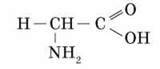
Загальна будова 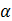 -амінокислоти
-амінокислоти
Послідовно сполучаючись між собою, залишки амінокислот формують молекулу білка. При цьому зв’язок утворюється між аміногрупою однієї амінокислоти й карбоксильною групою іншої з виділенням молекули води. Такий зв’язок називається пептидним: – CO-NH-
Рівні структурної організації білків
Послідовність залишків амінокислот, з’єднаних між собою пептидними зв’язками, називають первинною структурою білка. Це поліпептидний ланцюг.
Далі відбувається просторове укладання поліпептидного ланцюга, формується вторинна структура білка – спіраль або складчаста структура. Вона стабілізує водневі зв’язки.
Третинною структурою білка називається тривимірна упаковка поліпептидного ланцюга – глобула. Третинна структура стабілізується й утримується чотирма типами зв’язків, які утворюються між радикалами амінокислот:
1) дисульфідні зв’язки між атомами Сульфуру двох залишків цистеїну;
2) водневі зв’язки, що утворюються за участі атома Гідрогену амінокислотних радикалів;
3) гідрофобні взаємодії між радикалами неполярних амінокислот;
4) електростатичні (іонні) взаємодії між різнойменно зарядженими групами радикалів полярних амінокислот.
За просторовою формою третинної структури білки підрозділяються на глобулярні, поліпептидні ланцюги яких згорнуті в компактні сферичні або еліпсоподібні структури (інсулін, альбумін, усі ферменти), і фібрилярні, поліпептидні ланцюги яких, розташовуючись уздовж однієї осі, утворюють довгі волокна (фібрили) або шари (колаген, еластин, міозин, фібрин).
Деякі білки складаються не з одного, а з декількох поліпептид – них ланцюгів, або поліпептидних ланцюгів і речовин небілкової природи (гемоглобін, більшість ферментів). У цьому випадку говорять про четвертинну структуру білка, а поліпептидні ланцюги, які його утворюють, називають субодиницями. Четвертинна структура утворюється тільки після закінчення формування третинних структур окремих субодиниць і стабілізується гідрофобними й електростатичними взаємодіями.
Рівні структурної організації білків
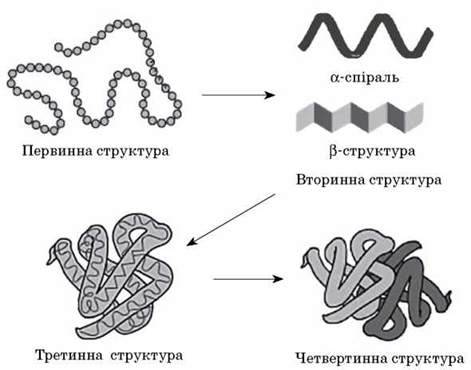
Властивості білків
Під впливом температури, механічного тиску, хімічних агентів відбувається порушення просторової організації молекули – четвертинної, третинної, вторинної структури зі збереженням первинної; білок утрачає свої фізико-хімічні й біологічні властивості. Це явище називається денатурацією. Якщо денатуруючий агент припиняє свою дію, у деяких випадках білок набуває початкової просторової конфігурації та відновлює біологічну активність. Процес відновлення фізико-хімічних і біологічних властивостей білка називається ренатурацією. Якщо вплив призводить до порушення первинної структури білка, то говорять про його гідроліз. Це необоротний процес.
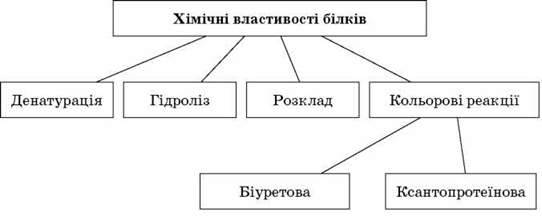
Хімічні властивості білків
Проектуємо схему на екран, а учні пояснюють функції білків.
Функції білків у організмі

1. Пластична. Білки входять до складу цитоплазми, клітинних органел і мембран. Сухожилля, суглобові з’єднання, кістки скелета, м’язи копита і т. д. складаються з білків.
2. Каталітична. Біологічні каталізатори, які прискорюють біохімічні реакції, називаються ферментами. Усі ферменти є білками.
3. Рухова. Будь-які форми активного руху в живій природі (робота м’язів, биття війок і джгутиків та ін.) здійснюються скоротливими білковими структурами.
4. Транспортна. Білок еритроцитів гемоглобін транспортує кисень від легень до тканин і органів, сироватковий білок альбумін здійснює транспорт жирних кислот. Білки клітинних мембран здійснюють вибіркове перенесення речовин (глюкози, амінокислот, іонів) між міжклітинним простором і цитоплазмою.
5. Захисна. Захист організму від дії інфекції, що потрапила до нього, і підтримка гомеостазу забезпечуються реакціями імунітету. Найважливішими чинниками гуморального імунітету є антитіла – білки. Також захисну функцію виконують білки, що безпосередньо руйнують клітини (лізоцим слини) або блокують процеси біосинтезу (інтерферон в інфікованих вірусами клітинах).
6. Регуляторна. Багато гормонів є білками (інсулін, глюкагон). Вони регулюють перебіг фізіологічних і біохімічних процесів – ріст клітин, обмін речовин.
7. Запасна. Білки здатні накопичуватися як запасний матеріал для живлення організму, що розвивається (яєчний альбумін, білки насіння рослин).
8. Білки розщеплюються для отримання енергії у виняткових випадках, якщо в організмі вичерпані запаси вуглеводів і жирів.
9. Рецепторна. Багато білків на поверхні плазматичної мембрани клітин здатні розпізнавати молекули певної структури.
ІІ. Жири
1) Як побудовані молекули жирів?
2) Які властивості мають жири?
3) Яка біологічна роль жирів?
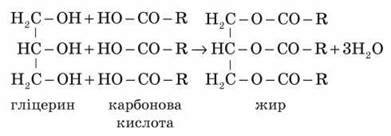
Жири – естери трьохатомного спирту гліцерину й вищих карбонових кислот. Серед них можуть бути як насичені кислоти, наприклад пальмітинова С15Н31СООН і стеаринова С17Н35СООН, так і ненасичені кислоти (у тому разі з одним подвійним зв’язком – наприклад, олеїнова кислота С17Н33СООН; з двома – лінолева кислота С17Н31СООН).
Фізичні властивості жирів
Тваринні жири (баранячий, свинячий, яловичий і т. п.), як правило, є твердими речовинами з невисокою температурою плавлення (виняток – риб’ячий жир). Рослинні жири – олії (соняшникова, соєва, бавовняна та ін.) є рідинами (виняток – кокосова олія). До складу молекул олій входять залишки ненасичених кислот. Рідкі жири перетворюють на тверді шляхом реакції гідрогенізації (гідрування). При цьому Гідроген приєднується по подвійному зв’язку, що міститься у вуглеводневому радикалі молекул Юлій. Продукт гідрогенізації олій – твердий жир (штучне сало, саломас). Маргарин – харчовий жир, складається із суміші гідрогенізованих олій (соняшникової, кукурудзяної, бавовняної та ін.), тваринних жирів, молока і смакових добавок (солі, цукру, вітамінів та ін.).
Хімічні властивості жирів
Жирам, як естерам, властива оборотна реакція гідролізу, каталізатором якої є мінеральні кислоти. За участі лугів гідроліз жирів відбувається необоротно. Продуктами в цьому випадку є мила – солі вищих карбонових кислот і лужних металів.
1) Складаємо рівняння реакції утворення жирів.
2) Пояснюємо відмінність у складі рослинних і тваринних жирів.
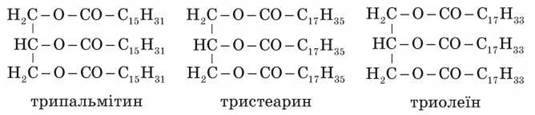

Із соняшника і плодів оливи добувають відповідно соняшникову й оливкову олії.

Жири тваринного походження
3) Біологічна роль жирів

Жири мають величезне біологічне значення. Вони виконують в організмі різні функції.
1. В організмі жири розкладаються з виділенням великої кількості енергії.
2. Жири охороняють організм від теплових утрат, тому що вони є поганим провідником тепла.
3. Жири використовуються для побудови клітин (структурний жир).
4. Жири відкладаються як запасна резервна речовина (резервний жир).
5. Жир захищає деякі органи (наприклад, нирки) від механічних впливів, тому що має визначену пружність.
6. У жировому тілі комах можуть накопичуватися кінцеві продукти обміну речовин. Жирова тканина у цих тварин здійснює видільну функцію.
7. Ліпіди входять до складу деяких біологічно активних речовин, наприклад певних гормонів. Вони беруть участь у регуляції життєвих функцій організмів: обміну речовин у тварин і рослин, процесах життєдіяльності в комах, наприклад линьки. Як розчинники гідрофобних органічних сполук жири забезпечують перебіг певних біохімічних процесів.
Жири в організмі можуть утворюватися не тільки з жирів, що надходять з їжею, але й у результаті синтезу з вуглеводів і білків.
III. Вуглеводи
1) Як побудовані молекули вуглеводів?
2) Які властивості мають вуглеводи?
3) Яка біологічна роль вуглеводів?
У природі деякі органічні речовини утворюються в рослинах з вуглекислого газу й води під дією сонячного світла. Як називають ці речовини? Вуглеводи. До вуглеводів належать, наприклад, глюкоза, сахароза, а також крохмаль і целюлоза. Це окремий клас речовин, які відрізняються від вуглеводнів і за будовою і за властивостями.
Проектуємо схему на екран.
Класифікація вуглеводів
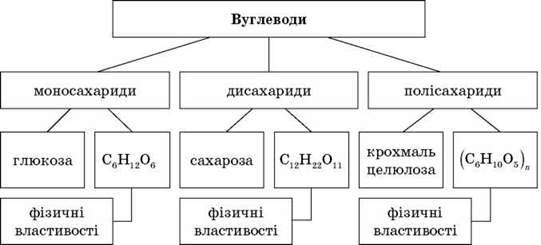
Фізичні властивості вуглеводів учні шукають та виписують самостійно з додаткової літератури.
Основні хімічні властивості вуглеводів
А. Глюкоза
А) Окиснення глюкози (рівняння);
Б) взаємодія з купрум(ІІ) гідроксидом як багатоатомний спирт (ознака);
В) спиртове бродіння.
Б. Сахароза Гідроліз (рівняння).
В. Крохмаль і целюлоза
А) Полімерна будова;
Б) реакція гідролізу крохмалю й целюлози;
В) якісна реакція крохмалю з йодом;
Г) порівняльна таблиця.
КРОХМАЛЬ | ЦЕЛЮЛОЗА | |
Молекулярна формула | (С6Н10О5)n | (С6Н10О5)n |
Ступінь полімеризації | N = від декількох сотень до декількох тисяч | N = 10-14 тисяч |
Середня молекулярна маса | Від декількох сотень до декількох тисяч | Кілька мільйонів |
Будова макромолекул | Спіральна, розгалужена | Лінійна, волокна |
Структурна ланка | Залишки | Залишки?-глюкози |
Функції вуглеводів

Енергетична. Під час окиснення у процесі клітинного дихання вуглеводи вивільняють енергію, яка в них міститься, забезпечуючи значну частину енергетичних потреб організму.
Захисна. В’язкі секрети (слизи), багаті на вуглеводи та їхні похідні – глікопротеїди, оберігають стінки органів (шлунок, кишечник, бронхи) від механічних і хімічних впливів.
Рецепторна. Більшість клітинних рецепторів є глікопротеїнами. Зв’язуючись із мембранними білками, вуглеводи у складі рецепторів беруть участь у розпізнаванні сигнальних молекул (гормонів, нейромедіаторів).
Пластична. Вуглеводи є основними структурними компонентами клітин, які утворюють опорні тканини (целюлоза, мембрани, хітин).
Запасна. Відкладаючись у тканинах, вуглеводи можуть забезпечити організм енергією під час голодування (крохмаль, глікоген).
IV. Нуклеїнові кислоти
1) Як побудовані молекули нуклеїнових кислот?
2) Які властивості мають нуклеїнові кислоти?
3) Яка біологічна роль нуклеїнових кислот?
Основні поняття:
– азотна основа;
– РНК;
– ДНК;
– нуклеозид;
– принцип комплементарності.
Складаємо схему будови нуклеотиду – складової частини нуклеїнових кислот.
Нуклеїнові кислоти (НК) – містяться в ядрі цитоплазми, мітохондріях, хлоропластах, рибосомах. Уперше їх добув І. Я. Горбачевський. Існує два типи: РНК (рибонуклеїнова кислота) та ДНК (дезоксирибонуклеїнова кислота).
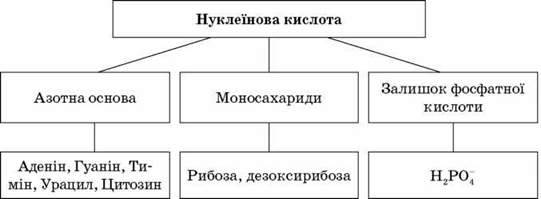
Загальна схема будови нуклеотиду нуклеїнових кислот
ДНК – один із двох типів природних нуклеїнових кислот, який забезпечує зберігання, передачу з покоління в покоління і реалізацію генетичної програми розвитку й функціонування живих організмів. Основна роль ДНК в клітинах – довготривале зберігання інформації про структуру РНК і білків.
У ДНК трапляється чотири види азотних основ (аденін, гуанін, тимін і цитозин).
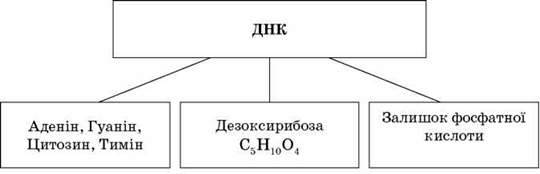
Дезоксирибонуклеїнова кислота є біополімером, мономерами якого є нуклеотиди. Кожен нуклеотид складається із залишку фосфатної кислоти, приєднаного до цукру дезоксирибози, до якого також через глікозидний зв’язок (C-N) приєднана одна з чотирьох азотистих основ. Саме наявність характерного цукру і є однією з головних відмінностей між ДНК і РНК.
З хімічної точки зору, ДНК – це довга полімерна молекула, що складається з послідовності блоків – нуклеотидів. Зв’язки між нуклеотидами в ланцюжку утворюються за рахунок дезоксирибози й фосфатної групи. У переважній більшості випадків (окрім деяких вірусів, що містять одноланцюжкові ДНК) макромолекула ДНК складається з двох ланцюжків, орієнтованих азотистими основами один проти одного. Важливим є те, що аденін завжди розміщується в парі з тиміном, а цитозин – з гуаніном. Ця дволанцюжкова молекула утворює спіраль. У цілому структура молекули ДНК отримала назву “подвійної спіралі”.
Розшифровка структури ДНК (1953 р.) стала одним з поворотних моментів в історії біології. За видатний внесок у це відкриття Френсісу Кріку, Джеймсу Вотсону і Морісу Вілкінсу було присуджено Нобелівську премію з фізіології та медицини 1962 р.
Учні відповідають за планом:
1) Подвійна спіраль ДНК.
2) Принцип комплементарності:
Азотні основи доповнюють одна одну:
Аденін – Тимін А-Т
Цитозин – Гуанін Ц-Г
3) Подібність побудови ДНК з гвинтовими сходами: “стояки” – це ланцюги вуглеводних і фосфатних груп, а “сходи” – це азотисті основи.
РНК (рибонуклеїнова кислота) – клас нуклеїнових кислот, лінійних полімерів нуклеотидів, до складу яких входять залишок фосфатні кислоти, рибоза (на відміну від ДНК, що містить дезоксирибозу) і азотисті основи – аденін, цитозин, гуанін і урацил (на відміну від ДНК, що містить замість урацилу тимін). РНК містяться головним чином у цитоплазмі клітин і рибосомах. Ці молекули синтезуються в клітинах усіх клітинних живих організмів. Основні функції РНК в клітинних організмах: 1) шаблон для трансляції генетичної інформації в процесах синтезу білка; 2) доставка відповідних амінокислот до рибосом. У вірусах є носієм генетичної інформації (кодує білки оболонки й ферменти вірусів).
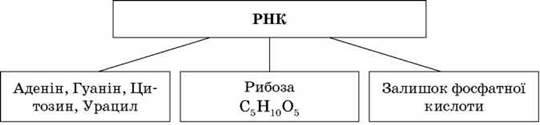
Відомо три основні типи РНК: інформаційна, або матрична (і-РНК, або м-РНК), транспортна (т-РНК) і рибосомна (р-РНК). Вони розрізняються місцем розташування в клітині, формою, розмірами та функціями. Інформаційна РНК є копією певної ділянки молекули ДНК (одного чи кількох генів). Вона переносить спадкову інформацію від ДНК до місця синтезу молекули білка, а також бере безпосередню участь у її збиранні. Частка і-РНК становить приблизно 2% від загальної кількості РНК клітини. Вторинна і третинна структури і-РНК формуються з допомогою водневих зв’язків, електростатичних та інших типів взаємодій. Молекула і-РНК відносно нестабільна, вона швидко розпадається на нуклеотиди. Наприклад, у мікроорганізмів і-РНК існує усього декілька хвилин, а в клітинах еукаріотів – декілька годин або днів.
V. Рівні структурної організації живих організмів
Живі організми – це цілісні біологічні системи, здатні до саморегуляції та самовідтворення. А в їхньому хімічному складі переважають органічні сполуки: білки, жири, вуглеводи, нуклеїнові І кислоти тощо.
Ви вже знаєте, що серед організмів є одноклітинні, колоніальні та багатоклітинні. Існують і неклітинні форми життя – віруси. Клітини багатоклітинних організмів диференціюються й утворюють тканини, органи й системи органів. Особини одного виду об’єднуються в популяції, а з популяцій різних видів формуються багатовидові угруповання – біоценози, біогеоценози тощо. Отже, зрозуміло, що жива матерія може перебувати на різних рівнях організації.
Складаємо схему (або проектуємо на екран).

Характеристика рівнів
Молекулярний. Будь-яка жива система складається з біологічних макромолекул – нуклеїнових кислот, білків, полісахаридів та інших органічних речовин. З цього рівня починаються різноманітні процеси життєдіяльності організмів: обмін речовин, перетворення енергії, передача спадкової інформації.
Клітинний. Клітина є структурно-функціональною одиницею всіх живих організмів, що населяють Землю (виняток становлять віруси). На клітинному рівні поєднуються процеси передачі інформації та перетворення речовин і енергії.
Організмений. Елементарною одиницею організменого рівня є особина (індивід), яка розглядається в розвитку – від моменту зародження до припинення існування – як жива система.
Популяційно-видовий. Популяція – надорганізмена система, в якій здійснюються елементарні еволюційні перетворення. На цьому рівні вивчають чинники, що впливають на чисельність популяцій та їх розвиток.
Біогеоценотичний. На цьому рівні здійснюється взаємодія організмів між собою і з чинниками неживої природи, що визначають їх чисельність, видовий склад і продуктивність.
Біосферний. На цьому рівні відбувається кругообіг речовин і перетворення енергії, пов’язані з життєдіяльністю всіх живих організмів нашої планети.
Проектуємо схему на екран.
Пояснюємо взаємозв’язок усіх рівнів структурної організації живих організмів.
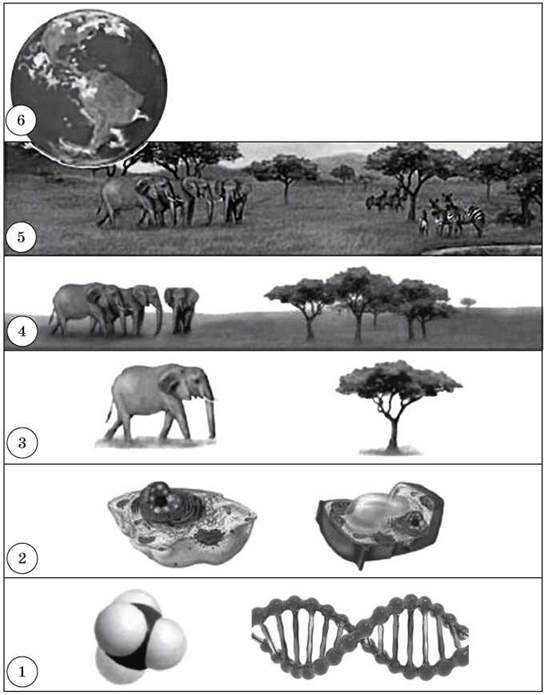
Мал. Рівні організації живої матерії:
1 – молекулярний (відбуваються біохімічні реакції, кодується спадкова інформація);
2 – клітинний (клітини складаються з молекул);
3 – організмений (багатоклітинні організми складаються з клітин);
4 – популяційно-видовий (види складаються з популяцій, а популяції – з окремих особин одного виду);
5 – екосистемний, або біогеоценотичний (складається з різних видів);
6 – біосферний (біосфера – сукупність усіх екосистем планети)
V. Усвідомлення й закріплення знань
Міні-тест
1) Мономерна ланка нуклеїнових кислот:
А) амінокислота;
Б) рибоза;
В) нуклеотид;
Г) глюкоза.
2) Вкажіть азотисту основу, яка не входить до складу ДНК:
А) гуанін;
Б) цитозин;
В) урацил;
Г) аденін.
3) Вкажіть моносахарид, який входить до складу РНК:
А) глюкоза;
Б) рибоза;
В) дезоксирибоза;
Г) фруктоза.
4) Нуклеотид складається з таких частин:
А) азотистої основи й залишку фосфатної кислоти;
Б) азотистої основи, моносахариду й залишку фосфатної кислоти;
В) азотистої основи й моносахариду;
Г) азотистої основи.
5) Вкажіть пари азотних основ за принципом комплементарності:
А) аденін-гуанін;
Б) аденін-тимін;
В) аденін-цитозин;
Г) цитозин-гуанін.
6) Вкажіть спільну властивість жирів, вуглеводів і білків:
А) приєднання;
Б) гідроліз;
В) денатурація;
Г) розклад.
7) Вкажіть функціональні групи амінокислот:
А) карбоксильна;
Б) гідроксогрупа;
В) аміногрупа;
Г) нітрогрупа.
8) Первинна структура білка – це:
А) спіраль;
Б) глобула;
В) ланцюг з амінокислот;
Г) розміщення у просторі декількох глобул.
9) Вторинна структура білка – це:
А) спіраль;
Б) глобула;
В) ланцюг з амінокислот;
Г) розміщення у просторі декількох глобул.
10) Вкажіть пептидний зв’язок:
А) – СООН;
Б) – NH2;
В) – ОН;
Г) – CO-NH-.
11) Денатурація – це:
А) розщеплення крохмалю;
Б) руйнування структур білка;
В) гниття решток живих організмів;
Г) те саме, що й гідроліз.
12) Третинна структура білка – це:
А) глобула;
Б) ланцюг з амінокислот;
В) розміщення у просторі декількох глобул;
Г) спіраль.
Застосовуємо прийом “Взаємоперевірка”.
VI. Підбиття підсумків уроку
VII. Домашнє завдання
 -глюкози
-глюкози