Особливості органічних сполук – ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 15. ОСНОВНІ ПОЛОЖЕННЯ ОРГАНІЧНОЇ ХІМІЇ
§ 15.2. Особливості органічних сполук
На відміну від неорганічних речовин органічні сполуки мають ряд характерних особливостей. Перш за все атоми карбону здатні сполучатися один з одним, утворюючи ланцюги і кільця, що не так типово для неорганічних сполук. Це одна з причин різноманітності органічних сполук.
В органічних молекулах зв’язок атомів ковалентний. Тому органічні речовини звичайно
Якщо іонні (неорганічні) сполуки легко дисоціюють у воді на іони і реакції між ними відбуваються досить швидко, то органічні речовини, що містять прості (одинарні) С-С – і С-Н – зв’язки, взаємодіють між собою дуже важко або зовсім не взаємодіють.
При нагріванні в межах 400-600 °С органічні сполуки повністю розкладаються і обвуглюються, а за наявності кисню згоряють. Це пояснюється порівняно невеликою міцністю зв’язку між атомами карбону (355,6 кДж/моль).
Важливою особливістю органічних сполук є й те, що серед них значно поширене явище ізомерії (див. § 15.3).
Особливості атома карбону
В органічній хімії звичайно користуються структурними формулами, оскільки атоми мають просторове розміщення в молекулі. Структурні формули – це мова органічної хімії.
У структурних формулах ковалентний зв’язок позначається рискою (див. § 3.10). Як і в структурних формулах неорганічних речовин, кожна риска означає спільну електронну пару, яка зв’язує атоми в молекулі. Використовуються також емпіричні та електронні формули. Такі формули зображено в § 3.8 для молекул води, аміаку та метану. Напишемо відповідні формули для етилену і ацетилену:
Емпіричні формули: С2Н4 С2Н2
Електронні формули: 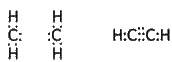
Структурні формули: 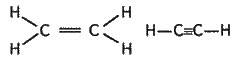
Як зазначалося у § 3.10, в органічній хімії замість поняття ступеня окиснення застосовують поняття валентності. Валентність атома карбону у збудженому стані завжди дорівнює чотирьом: він утворює чотири ковалентних зв’язки.