Постулати Бора
2-й семестр
АТОМНА І ЯДЕРНА ФІЗИКА
Тематичне планування
№ з/п | Тема уроку | Дата проведення |
1 | Постулати Бора | |
2 | Спектри випромінювання атомів і молекул | |
3 | Лабораторна робота № 6 “Спостереження суцільного й лінійчастого спектрів речовини” | |
4 | Люмінесценція | |
5 | Атомне ядро | |
6 | Ядерні сили | |
7 | Фізичні основи | |
8 | Радіоактивність | |
9 | Радіоактивні перетворення | |
10 | Закон радіоактивного розпаду | |
11 | Методи реєстрування іонізуючого випромінювання | |
12 | Лабораторна робота № 7 “Дослідження треків заряджених частинок за фотографіями” | |
13 | Ядерні реакції | |
14 | Елементарні частинки | |
15 | Узагальнювальний урок з теми “Атомна і ядерна фізика” | |
16 | Тематичне оцінювання |
УРОК 1/78
Тема
Мета уроку: ознайомити учнів з ядерною моделлю атома; розкрити шляхи виходу із кризи класичної фізики.
Тип уроку: урок вивчення нового матеріалу.
ПЛАН УРОКУ
Вивчення нового матеріалу | 33 хв. | 1. Ядерна модель атома. 2. Квантові постулати Бора. |
Закріплення вивченого матеріалу | 12 хв. | 1. Якісні питання. 2. Навчаємося розв’язувати задачі. |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Ядерна модель атома
Експерименти, проведені різними вченими протягом XIX сторіччя, довели, що атом має складну структуру. Фізикам стало відомо, що до складу атома входять електрони, які мають негативний заряд, хоча атом загалом є нейтральним.
Одну з перших моделей атома 1903 р. запропонував Томсон. Відповідно до моделі Томсона атоми являють собою однорідні кульки з позитивно зарядженої речовини, у якій містяться електрони. Сумарний заряд електронів дорівнює позитивному заряду атома. Тому атом загалом електрично нейтральний.
Ця модель дістала назву “пудинг”, тому що електрони були вкраплені в позитивно заряджене середовище, подібно до родзинок у пудингу.
Подальший прогрес у дослідженні внутрішньої структури атома був пов’язаний з ім’ям англійського фізика Ернеста Резерфорда.
Резерфорд запропонував своїм співробітникам експериментально перевірити спроможність моделі атома Томсона. Пропускаючи через дуже тонку металеву плівку вузький пучок швидких 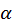 -частинок, експериментатори не повинні були виявити скільки-небудь помітного відхилення цих частинок. Резерфорд установив, що кожна
-частинок, експериментатори не повинні були виявити скільки-небудь помітного відхилення цих частинок. Резерфорд установив, що кожна 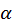 -частинка, потрапляючи на екран із сірчистого цинку, спричиняє спалах світла (див. рисунок).
-частинка, потрапляючи на екран із сірчистого цинку, спричиняє спалах світла (див. рисунок).
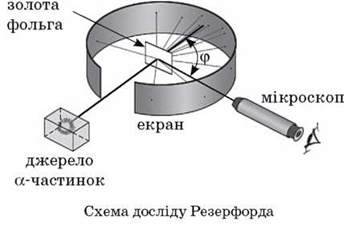
Зазнавши розсіювання в золотій фользі, 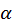 -частинки вдарялися потім в екран і їх реєстрували за допомогою мікроскопа. Зовсім зненацька виявилося, що приблизно одна
-частинки вдарялися потім в екран і їх реєстрували за допомогою мікроскопа. Зовсім зненацька виявилося, що приблизно одна 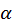 -частинка з 20 000, що падають на золоту фольгу завтовшки всього лише 4 – 10-5 см, повертається назад, у бік джерела.
-частинка з 20 000, що падають на золоту фольгу завтовшки всього лише 4 – 10-5 см, повертається назад, у бік джерела.
Резерфорду знадобилося кілька років, щоб остаточно зрозуміти настільки несподіване розсіювання 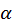 -частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об’ємі в центрі атома, а не розподілений по всьому атомі, як це було в моделі Томсона.
-частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об’ємі в центрі атома, а не розподілений по всьому атомі, як це було в моделі Томсона.
Резерфорд зміг визначити розмір атомного ядра. І виявилося, що атомне ядро в десятки тисяч разів менше від власне атома: розмір ядра – близько 10-14 -10-15 м, у той час як розмір атома – приблизно 10-10 м.
Грунтуючись на своїх дослідах і розрахунках, Резерфорд запропонував планетарну (ядерну) модель атома:
– атоми будь-якого елемента складаються з позитивно зарядженої частини, що дістала назву ядра;
– до складу ядра входять позитивно заряджені елементарні частинки – протони (пізніше було встановлено, що й нейтральні нейтрони);
– навколо ядра обертаються електрони, що утворюють так звану електронну оболонку.
Подібність атома із Сонячною системою посилювалася тим, що закон Кулона, що “керує” рухом електронів, збігається за формою із законом всесвітнього тяжіння, що “керує” рухом планет: і в тому, і в іншому випадку сила обернено пропорційна квадрату відстані.
2. Квантові постулати Бора
Відповідно до класичної теорії, система, що складається з масивного позитивно зарядженого ядра й легких, негативно заряджених електронів, може бути стійкою тільки в тому випадку, коли електрони перебувають у русі. Таким чином, атом має бути подібним до мініатюрної Сонячної системи, у якій роль Сонця відіграє ядро, а планет – електрон.
Рухаючись по “планетарних” орбітах, електрони повинні були б шляхом випромінювання втрачати енергію руху й у результаті швидко наближатися до ядра. Розрахунки показували, що електрон в атомі Гідрогену повинен випроменити всю свою енергію за малу частку секунди. Однак в атомі цього не відбувається.
Таким чином, в “атомних масштабах” суперечить досвіду не тільки класична електродинаміка, але й класична механіка – основа основ всієї класичної фізики.
Данський фізик Нільс Бор доповнив планетарну модель атома положеннями, які покликані були усунути недоліки цієї моделі. 1913 року опублікував свою квантову теорію атома. Основу цієї теорії становлять постулати Бора.
Перший постулат Бора:
O Існують особливі стани атома, у яких він не випромінює енергію. Такі стани називають стаціонарними станами.
O Стаціонарний стан атома означає, що його електрони локалізовані в просторі й мають певну енергію.
Момент імпульсу тіла визначають як L = m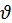 R, де m – маса тіла;
R, де m – маса тіла; 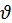 – модуль швидкості його руху; r – відстань до точки обертання тіла. Отже, відповідно до першого постулату Бора, орбітальний момент імпульсу електрона може набувати тільки дискретних значень:
– модуль швидкості його руху; r – відстань до точки обертання тіла. Отже, відповідно до першого постулату Бора, орбітальний момент імпульсу електрона може набувати тільки дискретних значень:
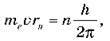
Де me – маса електрона; 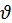 – швидкість руху електрона; rn – радіус стаціонарної орбіти атома; n = 1, 2, 3, 4, … (цілі числа); h – стала Планка.
– швидкість руху електрона; rn – радіус стаціонарної орбіти атома; n = 1, 2, 3, 4, … (цілі числа); h – стала Планка.
У ядерній фізиці часто використовують величину 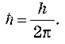
Другий постулат Бора:
O Будь-яке випромінювання атома пов’язане з його переходом з одного стаціонарного енергетичного стану в інший.
O Для переходу атома з одного стаціонарного стану в інший зі значеннями енергій E1 і E2 виконується рівність:
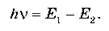
Для наочної демонстрації енергетичного стану атома застосовують спеціальні схеми. Кожний стаціонарний (дозволений) стан атома позначають лінією, яку називають енергетичним рівнем. Найнижчий рівень називають енергетичним рівнем основного стану. Вище від нього розташовані інші дозволені рівні. Переходи атома з одного стану в інший зображують вертикальними стрілками.
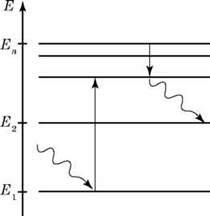
На рисунку показані енергетичні рівні атома Гідрогену. З теорії Бора випливає формула для енергії будь-якого збудженого стану атома Гідрогену: 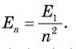
Всі енергетичні рівні відповідають негативним значенням енергії: нульове значення енергії відповідало б віддаленню електрона на нескінченно велику відстань від ядра, тобто іонізації атома. Найнижчий енергетичний рівень відповідає основному стану атома, а всі інші – збудженим. Для іонізації атома, що перебуває в основному стані, необхідно передати йому енергію, що дорівнює |E1| (це так звана енергія іонізації атома). Теорія Бора дає правильне значення енергії іонізації атома Гідрогену: 13,55 еВ.
Тепер можна пояснити, чому атоми є стабільними: без надходження енергії ззовні вони можуть переходити тільки в стан з меншою енергією. Зазвичай атом перебуває в збудженому стані недовго (біля 10-8 c), після чого переходить в основний стан. Якщо ж атом перебуває в основному стані, то переходити йому нікуди. Існування основного стану (стану з найменшою енергією) є загальною ознакою квантових систем.
Найбільший успіх теорія Бора мала стосовно атома Гідрогену, для якого виявилося можливим побудувати кількісну теорію. Однак уже для наступного за складністю атома – Гелію – домогтися кількісної згоди з дослідом не вдалося, не кажучи вже про складніші атоми.
Подальший розвиток фізики показав, що труднощі теорії Бора були пов’язані з її внутрішньою суперечливістю, тому що в ній поєднувалися закони класичної фізики й суперечні їм постулати Бора.
ПИТАННЯ ДО УЧНІВ У ХОДІ ВИКЛАДУ НОВОГО МАТЕРІАЛУ
Перший рівень
1. У чому полягають розбіжності між моделями атома, запропонованими Томсоном і Резерфордом?
2. Яким експериментальним даним суперечить планетарна модель атома?
3. Від чого залежить частота випромінюваного атомом світла?
4. У якому стані енергія електрона менше: в основному або в збудженому?
Другий рівень
1. Чому планетарна модель атома не узгоджується із законами класичної фізики?
2. Чому планетарна модель атома не могла пояснити подібність атомів?
3. Якими способами можна перевести атом у збуджений стан?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Якісні питання
1. Чи можна застосовувати закон Кулона для обчислення сили взаємодії альфа-частинки з ядром атома золота в досліді Резерфорда?
2. Які класичні уявлення про рух і взаємодію частинок покладені в основу теорії Бора?
3. У результаті яких змін, що відбуваються в атомі, виникає випромінювання?
2). Навчаємося розв’язувати задачі
1. Визначте радіус першої орбіти атома Гідрогену.
Розв’язання. Доцентрове прискорення електрона визначено кулонівською силою притягання до ядра атома Гідрогену:
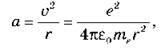
Де?0 – електрична стала.
Орбітальний момент імпульсу електрона на першій орбіті: me R1 = ђ. Одержимо вираз для квадрата швидкості:
R1 = ђ. Одержимо вираз для квадрата швидкості:
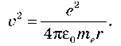
Запишемо рівняння для r1: 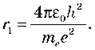
З огляду на те, що ђ = h/2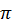 , маємо: r1 =
, маємо: r1 = 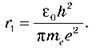
Перевіривши одиниці величин і підставивши чисельні значення, одержуємо, що радіус першої орбіти атома Гідрогену дорівнює 5,31 – 10-11 м.
2. На рисунку показані енергетичні рівні атома. Стрілками позначені переходи між рівнями. За яких переходів відбувається поглинання випромінювання? За якого переходу випускається випромінювання максимальної довжини хвилі? За якого переходу випускається випромінювання максимальної частоти?
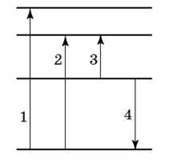
3. На скільки змінилася енергія електрона в атомі Гідрогену під час випромінювання атомом фотона довжиною хвилі 4,86 – 10-7 м?
4. Скориставшись рисунком, на якому показані енергетичні рівні атома Гідрогену, визначте довжину хвилі випромінювання, що відповідає переходу між першими й другим збудженими станами атома водовода.
Розв’язання. Перший збуджений стан відповідає другому знизу енергетичному рівню (n = 2), а другий збуджений стан – третьому (n = 3). Енергія фотона, що відповідає переходу між цими енергетичними рівнями, hv32 = E3 – E2.
Оскільки довжина хвилі?32 = c/v32, одержуємо 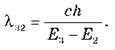
Перевіривши одиниці величин і підставивши числові значення в СІ (E2 = -5,4 – 10-19 Дж, E3 = -2,4 – 10-19 Дж), одержуємо:
?32 = 6,6 – 10-7 м.
5. Під час переходу атома Гідрогену із четвертого енергетичного стану на другий випромінюються фотони енергією 2,55 еВ. Визначте частоту випромінювання.
ЩО МИ ДІЗНАЛИСЯ НА УРОЦІ
– Постулати Бора.
1. Існують особливі стани атома, у яких він не випромінює енергію. Такі стани називають стаціонарними станами.
2. Будь-яке випромінювання атома пов’язане з його переходом з одного стаціонарного енергетичного стану в інший:
Hv = E1 – E2.
– Формула для енергії будь-якого збудженого стану атома Гідрогену: 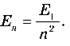
Домашнє завдання
1. Підр-1: § 50; підр-2: § 25 (п. 1, 2).
2. Зб.:
Рів1 № 16.1; 16.2; 16.3; 16.4.
Рів2 № 16.9; 16.10; 16.11; 16.12.
Рів3 № 16.16, 16.17; 16.18; 16.19.