Реакції рівноваги – Характеристики хімічної рівноваги
ХІМІЧНА РІВНОВАГА
1. Характеристики хімічної рівноваги
Багато хімічних реакцій оборотні. В якому напрямі вони проходитимуть залежить від наявних умов, наприклад, від температури.
1.1. Реакції рівноваги
В оборотних реакціях за певних і постійних умов можуть проходити як пряма, так і зворотна реакції.
Приклад. Суміш газоподібного йоду і водню реагує при підвищеній температурі, утворюючи гідроген йодид.
Н2 (r) + І2 (r) → 2 НІ (r).
При цьому швидкість реакції поступово знижується до постійних значень (умовно до нуля) (крива
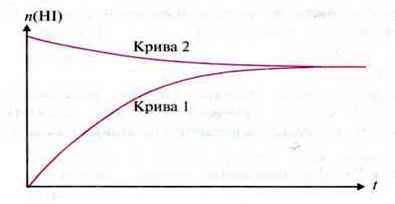
Проте повної взаємодії речовин не відбувається, оскільки при тій самій температурі гідроген йодид розкладається на йод і водень (крива 2):
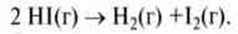
У результаті обох реакцій через певний час настає кінцевий стан, при якому всі речовини, що беруть участь у реакції, знаходяться в певних співвідношеннях.
Запам’ятайте: цей стан називають хімічною рівновагою.
Реакцію, в якій як початкові речовини, так і продукти реакції через певний час досягають сталого кількісного співвідношення, називають реакцією рівноваги.
Реакції рівноваги записують з двома стрілками:
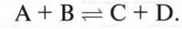
Related posts:
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- СТАН ХІМІЧНОЇ РІВНОВАГИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА СТАН ХІМІЧНОЇ РІВНОВАГИ Умова здійснення хімічної рівноваги: ΔH = ТΔS. За умови хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції. Стан рівноваги характеризує константа рівноваги К. Для системи За значенням константи рівноваги можна робити висновки про глибину протікання реакції: Перша реакція порівняно з другою протікає практично […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.2 . Зміна тиску Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок. Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2 2NH3. Кількість частинок […]...
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння Розділ 2 Кисень 19 Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння Матеріал параграфа допоможе вам: > з’ясувати, що таке схема хімічної реакції; > зрозуміти суть закону збереження маси речовин під час хімічної реакції; > навчитися перетворювати схеми реакцій на хімічні рівняння. Схема хімічної реакції. Існує кілька способів запису хімічних […]...
- ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Реакції, що супроводжуються виділенням теплоти, називаються екзотермічними. Наприклад, Реакції, що супроводжуються поглинанням теплоти, називаються ендотермічними. Наприклад, Кількість теплоти, що виділяється або поглинається в реакції, називається тепловим ефектом реакції. Тепловий ефект реакції ΔН – це різниця між вмістом енергії у вихідних речовинах і кінцевих продуктах реакції. Тепловий […]...
- ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Якщо система, що знаходиться в рівновазі, піддається зовнішньому впливу, рівновага зміщується у напрямку послаблення цього впливу. Відповідно до принципу Ле Шательє під час нагрівання рівновага зміщується у бік ендотермічної реакції; при підвищенні тиску – у бік реакції, яка проходить зі зменшенням […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімічний процес як перетворення одних речовин в інші описується за допомогою рівняння хімічної реакції. При складанні рівняння варто враховувати, що число атомів кожного елемента зліва і справа повинно бути однаковим (адже в рівнянні вказано знак рівності), тому перед формулами речовин-реагентів і речовин-продуктів ставляться числові […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- ЕНТАЛЬПІЙНИЙ І ЕНТРОПІЙНИЙ ФАКТОРИ І НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТАЛЬПІЙНИЙ І ЕНТРОПІЙНИЙ ФАКТОРИ І НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням Можливість реакції Визначає ентальпійний фактор: ΔH < 0. Можливість реакції Визначає ентропійний фактор: TΔS > 0. Реакція протікає за високої температури....
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Реакції в гетерогенному і гомогенному середовищі ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Більшість хімічних реакцій “миттєво” не відбуваються. Для реакції між початковими речовинами й утворенням продуктів потрібний певний час, який може бути дуже коротким. Запам’ятайте: реакції між Іонами відбуваються, як правило, набагато швидше, ніж реакції між молекулами. 1. Реакції в гетерогенному і гомогенному середовищі Реакції можуть відбуватися між речовинами в гетерогенному середовищі (наприклад, суміші […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Тема 2 КИСЕНЬ & 24. СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Вивчення параграфа допоможе вам: · пояснювати суть рівнянь хімічних реакцій; · розрізняти схему і рівняння хімічної реакції, коефіцієнти й індекси; · у рівняннях хімічних реакцій розрізняти реагенти і продукти реакцій; · писати рівняння хімічних реакцій з дотриманням закону збереження маси речовин До цього часу […]...