Роль електроліту – Батареї – Електрохімія
ОКИСНЕННЯ І ВІДНОВЛЕННЯ
3. Електрохімія
3.3. Батареї
Батарея складається з трьох частин:
– негативний електрод, що віддає електрони при проходженні струму, тобто окислюється;
– позитивний електрод, що отримує електрони при проходженні струму, тобто відновлюється;
– електроліт, який має хорошу електричну провідність і тому забезпечує низький / внутрішній опір батареї.
Приклад. Широко вживана батарея – лужна / марганцева батарея. Напруга між полюсами становить 1,5 В.
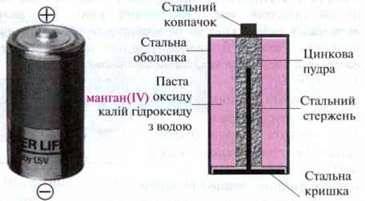
Електроліт
Негативний електрод: Zn → Zn2+ + 2е-.
Позитивний електрод: 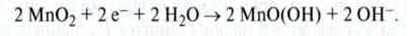
Роль електроліту
Йони Цинку і гідроксид-іони, які утворюються під час окисно-відновного процесу, дифундують в електроліт і утворюють малорозчинний цинк гідроксид, який знижує провідну здатність електроліту. Проте висока концентрація гідроксид-іонів запобігає утворенню цього продукту і відповідно швидкому збільшенню внутрішнього опору:
Zn2+ + 2 ОН – → Zn(OH)2 важкорозчинний
Zn(OH)2 + 2 ОН – → 2- легкорозчинний
Запам’ятайте: електроліт не бере участі в окисно-відновній реакції, але реагує з продуктами реакції і впливає на термін придатності батареї.
Related posts:
- Внутрішній опір і термін придатності батарей – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Внутрішній опір і термін придатності батарей Батарея є електричним пристроєм і тому як будь-який інший пристрій має електричний опір, так званий внутрішній опір. Якщо до батареї підключити споживач, наприклад, лампу, то на неї подається не повна напруга джерела, а зменшена напруга на контактах (клемах). Uкл = U0 – […]...
- Розрядження акумулятора – Акумулятори – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.4 . Акумулятори Акумулятор – це електрохімічний елемент, який після використання можна знову зарядити і, відповідно, використовувати багато разів. Щоб електрохімічний елемент можна було заряджати, продукти, що утворюються при розрядженні, не повинні розчинятися в електроліті, а залишатися на електродах. Приклад. Найпоширеніший акумулятор – свинцевий акумулятор, що використовують в автомобілях. Напруга […]...
- БАТАРЕЇ (АКУМУЛЯТОРНІ) Екологія – охорона природи БАТАРЕЇ (АКУМУЛЯТОРНІ) – пристрої, здатні акумулювати хім. енергію, яка в процесі їх розряджання перетворюється на електричну. Б. здебільшого складаються з двох електродів і електроліту, найчастіше рідкого. Між електродами виникає електрична напруга. Залежно від електродів і електроліту розрізняють кілька систем Б. Ртутні Б. одноразового використання застосовують, зокрема, в слухових апаратах, годинниках, експонометрах, […]...
- Напруга розкладу – Електроліз ОКИСНЕННЯ І ВІДНОВЛЕННЯ 4 . Електроліз Електроліз – це зворотний процес окисно-відновної реакції, що спонтанно протікає в батареї. При використанні електричної енергії примусово викликають процес окисно-відновної реакції. Водночас електрична енергія перетворюється на хімічну енергію. В обох випадках електрод, на якому відбувається окиснення, називають анодом (анодний протектор). Електрод, на якому відбувається відновлення, називають катодом. У батареї […]...
- Електрохімічний ряд напруг металів – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.2. Електрохімічний ряд напруг металів Щоб використовувати окисно-відновну реакцію, яка проходить між металом і іонами менш активного металу, для отримання електричної енергії, також потрібно провести просторове розділення “партнерів” окисно-відновної реакції. Приклад. Якщо пластинку заліза помістити в розчин, що містить іони Феруму, а мідну пластинку в розчин, який містить іони Купруму, […]...
- Гальванічні елементи – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія Окисно-відновні реакції можна використовувати в техніці. У цьому випадку перехід електронів між окисно-відновними парами здійснюється по електричному провіднику і є електричним струмом. Частина зміни ентальпії реакції перетворюється на електричну енергію. 3.1. Гальванічні елементи Якщо цинкову й мідну пластинку помістити в розведену сульфатну кислоту, то між двома металами можна буде виміряти […]...
- Заряджання акумулятора – Акумулятори – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.4 . Акумулятори Заряджання акумулятора Якщо до полюсів розрядженого акумулятора прикласти постійну напругу, то окисно-відновна реакція проходитиме в зворотному порядку: – на електроді акумулятора, сполученого з негативним полюсом зарядного пристрою, плюмбум сульфат відновлюється в металічний свинець; – на електроді акумулятора, з’єднаного з позитивним полюсом зарядного пристрою, плюмбум сульфат окислюється, перетворюючись […]...
- Киснева корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.2. Киснева корозія Залізо – один із найважливіших матеріалів, який, на жаль, має здатність іржавіти на вологому повітрі. На першому етапі в процесі окисно-відновної реакції залізо окислюється, а кисень повітря відновлюється. Окиснення: Відновлення: Іони Феруму, що утворюються під час окисно-відновної реакції і гідроксид-іони рухливі та вступають у реакцію між […]...
- Корозія металів – Метали Хімія Неорганічна хімія Метали Корозія металів Корозія – руйнування металу під дією навколишнього середовища. Це окисно-відновний процес. Хімічна корозія – руйнування металу під час його окиснення без виникнення електричного струму в системі. При цьому метал взаємодіє з газами (газова корозія) і рідкими неелектролітами (бензин, нафта, толуол та ін.). Наприклад, сполука металів із киснем повітря. Електрохімічна […]...
- Суть електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.6. Суть електролізу У розчинах і розплавах електролітів є різнойменні за знаками іони (катіони й аніони), які подібно до всіх частинок рідини перебувають у хаотичному русі. Якщо в такий розчин або розплав електроліту, наприклад у розплав […]...
- ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ – СТРУМ В ЕЛЕКТРОЛІТАХ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 3. ЕЛЕКТРИЧНИЙ СТРУМ У РІЗНИХ СЕРЕДОВИЩАХ 3.2. СТРУМ В ЕЛЕКТРОЛІТАХ 3.2.2. ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ Електроліз – виділення речовини на електродах при проходженні струму через електроліт. Електроліз супроводжується окисно-відновними реакціями. Закон електролізу (закон Фарадея). Маса виділеної на електроді речовини прямо пропорційна заряду, що пройшов через електроліт: Тут k […]...
- Загальні способи добування металів. Електроліз розплавів солей і лугів – Метали Хімія Неорганічна хімія Метали Загальні способи добування металів. Електроліз розплавів солей і лугів Металургія – це галузь промисловості, яка займається видобуванням металів із руд. Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму через розплав або розчин електроліту. Якщо в розплав електроліту, наприклад натрій хлориду, занурити інертні електроди й пропускати постійний […]...
- ЕЛЕКТРОЛІЗ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ЕЛЕКТРОЛІЗ ВОДИ Електроліз води – окисно-відновний процес розкладу води з утворенням водню і кисню. На катоді відбувається відновлення води з утворенням іонів ОН – і молекул Н2: На аноді здійснюється окиснення води з утворенням молекул О2 і іонів Н+: Дія електричного струму призводить […]...
- ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції проходять за рахунок переходу електронів або атомів від одних частинок до інших. У реакції Відбувається перехід електронів від атомів заліза (відновник) до іонів Купруму (окисник). В реакції Відбувається перехід атомів Оксигену від іонів СlO – (окисник) до йонів SO32- […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- РОБОТА I ПОТУЖНІСТЬ СТРУМУ. ЗАКОН ДЖОУЛЯ-ЛЕНЦА – ЗАКОНИ ПОСТІЙНОГО СТРУМУ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 2. ЗАКОНИ ПОСТІЙНОГО СТРУМУ 2.5. РОБОТА I ПОТУЖНІСТЬ СТРУМУ. ЗАКОН ДЖОУЛЯ-ЛЕНЦА Робота струму Потужність струму Закон Джоуля-Ленца про кількість теплоти, яка виділяється при проходженні струму: Якщо в провіднику струм справляє тільки теплову дію, то А = Q:...
- Тема 12. Електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Тема 12. Електролітична дисоціація Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Вкажіть речовину, за допомогою якої можна визначити сульфат-іони у розчині: A. Калій перманганат; Б. Лакмус; B. Барій нітрат; Г. Купрум(ІІ) гідроксид. 2. Позначте іони, що знаходяться […]...
- Типи окисно-відновних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.7. Типи окисно-відновних реакцій Розрізняють 3 типи окисно-відновних реакцій: міжмолекулярні, внутрішньо-молекулярні та реакції диспропорціонування. 1. Міжмолекулярні окисно-відновні реакції У таких реакціях елемент, що віддає електрони, та елемент, що їх приєднує, містяться в складі різних молекул. Наприклад: 2. Внутрішньо-молекулярні окисно-відновні реакції […]...
- ГІДРОКСИД НАТРІЮ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ГІДРОКСИД НАТРІЮ Гідроксид натрію NаОН широко відомий під назвою їдкий натр. Цю назву (історично вона була першою) він отримав завдяки високій хімічній активності стосовно тваринних тканин – “їдкості” (як і гідроксиди всіх інших лужних металів). Його технічна назва – каустична сода. Гідроксид натрію – розчинна у воді основа, тобто […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- ПАЛИВНИЙ ЕЛЕМЕНТ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ПАЛИВНИЙ ЕЛЕМЕНТ Паливний елемент – гальванічний елемент, у якому окисно-відновна реакція підтримується безперервною подачею реагентів (окисника і відновника) та видаленням продуктів реакції. У воднево-кисневому елементі (рис. 40) в електричну енергію перетворюється енергія хімічної реакції Рис. 40. Схема паливного елемента. Електроліт – розчин лугу. […]...
- Електроліз РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 55. Електроліз Усвідомлення змісту цього параграфа дає змогу: Формулювати означення електролізу; Пояснювати суть електролізу розплавів і розчинів солей; Прогнозувати склад продуктів електролізу: розплавів солей, розчинів солей за активністю йонів у розчині; Складати рівняння реакцій електролізу, схеми окисно-відновних процесів на електродах; Характеризувати практичне значення електролізу. Значна кількість металів […]...
- Лабораторна робота № 9 “Дослідження явища електролізу” 1-й семестр ЕЛЕКТРОМАГНІТНІ ЯВИЩА 2. Електричний струм Урок 27/33 Тема. Лабораторна робота № 9 “Дослідження явища електролізу” Мета уроку: експериментально перевірити виконання закону електролізу. Тип уроку: урок контролю й оцінювання знань. Обладнання: електролітична ванна з водним розчином мідного купоросу (CuSO4) і мідними електродами, джерело струму, секундомір, амперметр, ваги з важком, фільтрувальний папір, ключ, з’єднувальні проводи. […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- SN1-механізм – Нуклеофільне заміщення ОРГАНІЧНІ РЕАКЦІЇ 3. Іонні реакції 3.3 . Нуклеофільне заміщення Атом галогену, сполучений з атомом Карбону, може легко витіснятися нуклеофілом у вигляді аніона, наприклад, гідроксид-іоном, який має електронну пару. Приклад. Монобромоетан реагує з водним розчином їдкого натру, утворюючи етанол: Реакція галогеноалканів з гідроксид-іоном може проходити двома різними шляхами. SN 1 – механізм Нуклеофільна реакція заміщення відбувається […]...
- Сполучення провідників – ПОСТІЙНИЙ ЕЛЕКТРИЧНИЙ СТРУМ Формули й таблиці ФІЗИКА ПОСТІЙНИЙ ЕЛЕКТРИЧНИЙ СТРУМ Сила струму І – сила струму, , ; Δq – заряд, що проходить через поперечний переріз провідника за час Δt; Q0 – заряд вільної зарядженої частинки, ; N – концентрація носіїв заряду, ; – середня швидкість їх упорядкованого руху, ; S – площа поперечного перерізу провідника, . Електрорушійна […]...
- НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ НАПРЯМОК ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ У РОЗЧИНІ Для кількісної характеристики окисно-відновних можливостей речовин, що знаходяться в розчинах або стикаються з ними, використовують електродні (окисно-відновні) потенціали Е. Взаємозв’язок ΔG і Е виражається рівнянням Де n – число молів електронів, переданих у процесі; F = 96 485 […]...
- ЕРС. ЗАКОН ОМА ДЛЯ ПОВНОГО КОЛА. З’ЄДНАННЯ ЕЛЕМЕНТІВ – ЗАКОНИ ПОСТІЙНОГО СТРУМУ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 2. ЗАКОНИ ПОСТІЙНОГО СТРУМУ 2.4. ЕРС. ЗАКОН ОМА ДЛЯ ПОВНОГО КОЛА. З’ЄДНАННЯ ЕЛЕМЕНТІВ Джерело струму – це пристрій, у якому діють сторонні сили, що розділяють заряди (рис. 22). Рис. 22 Кулонівські сили завжди з’єднують різнойменні заряди. У замкненому колі діють сторонні сили в джерелі й кулонівські сили у […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Окисно-відновні реакції – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Окисно-відновні реакції За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на: 1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, […]...