Електрохімічний ряд напруг металів – Електрохімія
ОКИСНЕННЯ І ВІДНОВЛЕННЯ
3. Електрохімія
3.2. Електрохімічний ряд напруг металів
Щоб використовувати окисно-відновну реакцію, яка проходить між металом і іонами менш активного металу, для отримання електричної енергії, також потрібно провести просторове розділення “партнерів” окисно-відновної реакції.
Приклад. Якщо пластинку заліза помістити в розчин, що містить іони Феруму, а мідну пластинку в розчин, який містить іони Купруму, то між двома металами виникне електрична напруга. Якщо провідником з’єднати пластинки, які
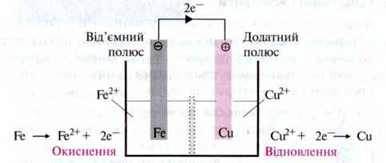
Метали, занурені в розчин однойменних іонів, утворюють гальванічний напівелемент. Вони мають певну здатність віддавати електрони та переходити в розчин як іони.
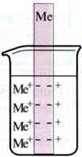
Відповідні іони металів прагнуть у свою чергу отримати електрони й осісти в гратку металів.
Тому, якщо опустити метал у розчин солі, що містить відповідні іони металів, то між металом і його іонами цієї сполученої окисно-відновної пари встановлюється рівновага реакції:
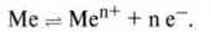
За
Тому на межі між металом і розчином утворюється подвійний електричний шар, який можна порівняти із зарядженим конденсатором.
Різницю зарядів у граничному шарі називають електродним потенціалом, який має певне значення для кожної окисно-відновної пари, що складається з металу і зв’язаного іона металу.
Запам’ятайте: електродний потенціал залежить від виду окисно-відновної пари і від концентрації іонів у розчині. Окисно-відновні (електродні) потенціали недоступні для прямого вимірювання. Тому для порівняння використовують іншу окисно-відновну пару і визначають різницю потенціалів.
За точку відліку для порівняння електродних потенціалів використовують рівновагу між елементарним воднем і іонами гідроксонію (спрощено Н+):
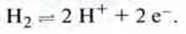
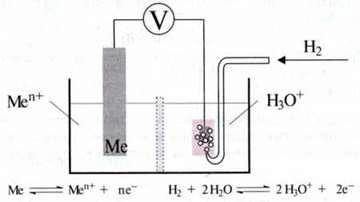
Цей так званий стандартний водневий електрод є платиновою пластинкою, що омивається газоподібним воднем, яка занурена в розчин кислоти з концентрацією с(Н3О+) = 1 моль/л при температурі Т = 298 К (= 25 °С).
Окисно-відновний потенціал стандартного водневого електрода прийнято вважати рівним нулю Е0Н = 0 В.
Різну здатність металів переходити в розчин шляхом віддавання електронів виражають електрохімічним рядом напруг, в основі яких лежать їхні стандартні потенціали, цей ряд відповідає окисно-відновному ряду металів.
Запам’ятайте: стандартний потенціал активних металів, розчинних у кислотах, – негативний, стандартний потенціал неактивних металів, нерозчинних у кислотах, – позитивний.
Стандартні потенціали двох окисно-відновних пар дозволяють розрахувати напругу між відповідними напівелементами так званого гальванічного елемента. При цьому необхідна наявність стандартних умов, тобто концентрація розчинених іонів повинна складати с = 1 моль/л.
Приклад. Елемент Даніеля складається з мідного і цинкового електродів, занурених відповідно в розчин купрум(ІІ) сульфату і цинк сульфату. Напруга між електродами становить
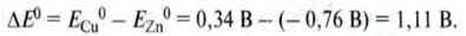
При цьому цинковий електрод є негативним електродом, оскільки віддає електрони міді:

Увага: в гальванічному елементі електрони переходять від окисно-відновної пари з більш негативним потенціалом до окисно-відновної пари з більш позитивним потенціалом.
