Розподіл електронів в атомі
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
БУДОВА АТОМА
Розподіл електронів в атомі
Місткість орбіта лей
На кожній орбіталі максимально можуть розміститися два електрони, які мають однакову енергію, але відрізняються особливою властивістю – спіном. Спін електрона – це його внутрішня властивість, що характеризує відношення електрона до магнітного поля.
Одна орбіталь може містити такі два електрони, в яких спіни антипаралельні. Це правило називають принципом заборони Паулі:
Графічно електрони зображають у вигляді стрілок, спрямованих угору або вниз, що наочно позначають напрямок спіну електрона. Стрілки, спрямовані в протилежні боки, позначають електрони з протилежними спінами:
 – вільна (вакантна або незаповнена) орбіталь;
– вільна (вакантна або незаповнена) орбіталь;
 – орбіталь, що містить один електрон; такий електрон називають неспареним;
– орбіталь, що містить один електрон; такий електрон називають неспареним;
 – заповнена орбіталь, що містить два електрони з протилежними спінами;
– заповнена орбіталь, що містить два електрони з протилежними спінами;
Принцип найменшої енергії
Усі хімічні властивості речовин визначаються будовою електронних оболонок атомів. Для того щоб описати електронну будову атомів, необхідно знати, як саме розподілені електрони по орбіталях.
Електрони займають енергетичні рівні орбіталі послідовно, за порядком збільшення їхньої енергії. Спочатку “заселяється” перший енергетичний рівень, потім – другий, третій тощо. Цей принцип називають принципом найменшої енергії.
Число енергетичних рівнів, які заповнюються в певному атомі, визначають за номером періоду Періодичної системи, в якому розташований певний хімічний елемент. Так, в атомах хімічних елементів першого періоду заповнюється тільки перший енергетичний рівень, в атомах другого періоду – перші два енергетичні рівні, третього – три тощо.
Гідроген розташований у першому періоді під номером 1. Із цього випливає, що в електронній оболонці атомів Гідрогену є тільки один електрон, який розташований на першому енергетичному рівні на єдиній s-орбіталі:
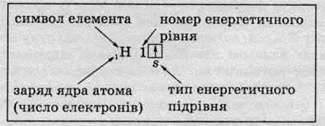
Окрім графічного зображення будови електронної оболонки, використовують також її запис у вигляді формули – електронної конфігурації, в якій наводять усі зайняті енергетичні підрівні із зазначенням числа електронів на кожному з них. Електронна конфігурація Гідрогену 1s1.

Тим часом в елементів другого періоду починає заповнюватися електронами другий енергетичний рівень. Незалежно від числа енергетичних рівнів, електрони спочатку заповнюють найбільш низький рівень, тобто в цьому разі перший, а потім уже другий. Як приклад, розгляньмо будову електронної оболонки Літію, що містить три електрони (порядковий номер – 3). Оскільки перший рівень максимально вміщає два електрони, то на другому міститься тільки один електрон. Згідно із принципом найменшої енергії, кожен електрон розташовується таким чином, щоб його енергія була найменшою, адже серед вільних орбіталей він обирає орбіталь із найбільш низькою енергією. Серед різних орбіталей s-орбіталі мають найменшу енергію, тому єдиний електрон другого енергетичного шару буде розташований на s-орбіталі, а р-орбіталі в цьому разі залишаються вільними:
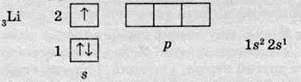
Наступний електрон також має обрати ту саму орбіталь. Доти, доки не заповниться поточний підрівень, наступний заповнюватися не починає. Так, в атомі Берилію (порядковий номер – 4) повністю заповнюється s-підрівень, утворюючи електронну пару, а р-підрівень знову залишається вільним:
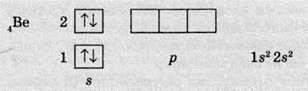
Тільки тоді, коли s-орбіталь заповнена, електрони починають розташовуватися на р-орбіталях. Так, в атомі Бору (порядковий номер – 5) на р-орбіталі вже з’являється один електрон:
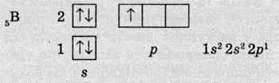
Правило Хунда
В атомі Карбону ще на один електрон більше, ніж в атомі Бору. Новий електрон може зайняти або ту саму р-орбіталь, де вже перебуває електрон, або вільну р-орбіталь. У цьому разі діє правило, згідно з яким електрон займає вільну орбіталь, якщо вона є, а вже потім утворює пари з іншими електронами. Це правило називають правилом Хунда: у межах одного енергетичного підрівня електрони розташовуються таким чином, щоб число неспарених електронів було максимальним.
Згідно із цим правилом, в електронній оболонці атома Карбону існує два неспарені електрони:
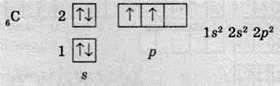
Тільки тоді, коли на р-підрівні розташується більше трьох електронів, “зайвий” електрон утворює електронну пару з іншим електроном, що вже розташований на цьому підрівні.
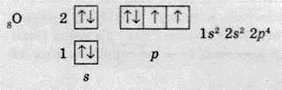
Будова електронних оболонок атомів третього та четвертого Періодів
Електронні оболонки атомів інших періодів заповнюються за такими самими правилами. Так, в атомів першого елемента третього періоду – Натрію – починає заповнюватися третій енергетичний рівень:
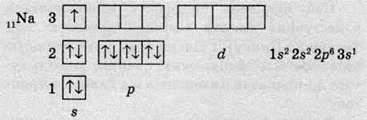
В атомі Натрію на третьому енергетичному рівні з’являється третій підрівень, що складається з d-орбіталей, але, як і р-підрівень, в атомах Натрію орбіталі d-підрівня ще не заповнюються й залишаються вакантними.
В атомах останнього елемента третього періоду – Аргону – додається ще сім електронів і стають повністю зайнятими s – і р-орбіталі:
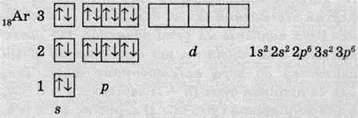
В атомах елементів четвертого періоду починає заповнюватися електронами четвертий енергетичний рівень, незважаючи на те, що третій рівень ще не заповнений. Це пов’язано з тим, що енергія 4s-підрівня менша, ніж енергія 3d-підрівня, хоча в цьому разі d-підрівень розташований на більш близькому до ядра електронному шарі. В атомах першого елемента четвертого періоду – Калію – останній електрон розташовується на 4s – підрівні:
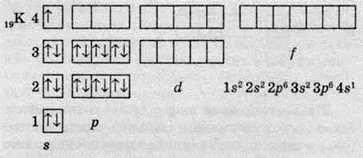
І тільки після того, як 4s-підрівень заповниться (це відбувається в атомах Кальцію), починає заповнюватися 3d-підрівень. Так, в атомах Скандію останній електрон буде розташований на 3d-орбіталі:
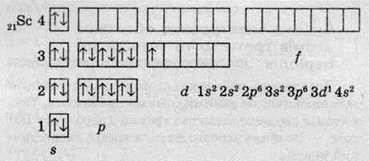
Цей підрівень продовжує заповнюватися в наступних дев’яти хімічних елементах (від Титану до Цинку), і тільки тоді, коли повністю заповнюється 3d-підрівень, починає заповнюватися 4р-підрівень в елементів від Галію до Криптону.
Порівняти енергію різних електронних підрівнів можна за допомогою суми двох чисел (n + l). Число n – це номер енергетичного рівня, де перебувають орбіталі, а l – це число, що відповідає енергетичному підрівню (типу орбіталі). Так, s-орбіталям відповідає число l = 0, р-орбіталям – l = 1, d-орбіталям – l = 2, f-орбіталям – l = 3. Згідно із правилом Клечковського, підрівні заповнюються електронами за порядком збільшення їхньої суми (n + l), а якщо для двох підрівнів ця сума однакова, то заповнюється той підрівень, що перебуває на більш близькому до ядра електронному шарі. Так, для 4s-підрівня сума (n + l) дорівнює 4 + 0 = 4, а для 3d-підрівня сума (n + l) дорівнює 3 + 2 = 5. Отже, енергія 4s-підрівня менша, ніж 3d-підрівня, і тому він заповнюється раніше. У такий спосіб можна порівнювати енергії будь-яких енергетичних підрівнів.