Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння
Розділ 2 Кисень
19 Схема хімічної реакції. Закон збереження маси речовин під час хімічної реакції. Хімічне рівняння
Матеріал параграфа допоможе вам:
> з’ясувати, що таке схема хімічної реакції;
> зрозуміти суть закону збереження маси речовин під час хімічної реакції;
> навчитися перетворювати схеми реакцій на хімічні рівняння.
Схема хімічної реакції. Існує кілька способів запису хімічних реакцій. З одним із них ви ознайомилися в & 17. Наводимо ще один приклад:
Сірка + кисень -> сірчистий газ.
Такий запис
S + О2→ SО2.
У схемах реакцій над стрілками часто вказують умови, за яких відбуваються перетворення: нагрівання 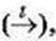 підвищений тиск
підвищений тиск 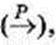 освітлення
освітлення 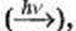 наявність додаткових речовин
наявність додаткових речовин 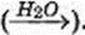
Якщо продуктом реакції є газ, то після його формули записують стрілку, направлену вгору (↑), а якщо утворюється осад,
Приклад схеми реакції з додатковими позначками і назвами речовин:
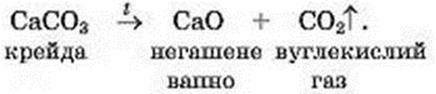
Цікаво знати
Схеми реакцій у алхіміків виглядали так:
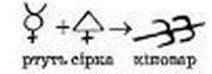
► Назвіть хімічні елементи, якими утворені вихідна речовина і продукти цієї реакції.
Схема реакції дає змогу зробити важливий висновок: усі хімічні елементи лід час реакції зберігаються.
Закон збереження маси речовин під час хімічної реакції. Загальновідомо, що після спалювання паперу залишається набагато менша маса попелу. Якщо ж сильно нагрівати (прожарювати) мідну пластину на повітрі, то виявимо протилежне – маса пластини зростатиме (метал покриватиметься чорним нальотом).
1 Для сірки тут і далі використовуватимемо формулу S, а не S, яку насправді має молекула цієї речовини.
Михайло Васильович Ломоносов (1711-1765)
Видатний російський учений, перший російський академік Петербурзької академії наук. Розробив одну з теорій будови речовин (40-ві роки XVIIІ ст.). Відкрив закон збереження маси речовин під час хімічних реакцій і закон збереження руху (1748-1760). Вивчав хімічні властивості металів, аналізував склад мінералів, розробив способи виготовлення мінеральних фарб, кольорового скла. Зробив вагомий внесок у розвиток “хімічної мови”. Автор книжок з історії Росії, поет, художник, геолог, географ, інженер, педагог. Один із засновників першого в Росії Московського університету.

Здійснимо обидва хімічні перетворення в закритих посудинах. Результати дослідів будуть іншими. Зваживши закриті посудини з речовинами до і після кожного експерименту, виявимо, що сумарна маса речовин у результаті реакцій не змінюється. Відповідну гіпотезу висловив у 1748 р. російський учений М. В. Ломоносов, а в 1756 р. підтвердив її, провівши серію хімічних експериментів. Не знаючи про відкриття Ломоносова, аналогічного висновку дійшов у 1789 р. французький учений А.-Л. Лавуазье.
Ломоносов і Лавуазье відкрили закон збереження маси речовин під час хімічної реакції. Його формулюють так: маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції.
Пояснимо, чому маси попелу і прожареної міді відрізняються від мас паперу і міді до її нагрівання.
Антуан-Лоран Лавуазье (1743-1794)
Видатний французький хімік, один із засновників наукової хімії. Академік Паризької академії наук. Започаткував кількісні (точні) методи дослідження в хімії. Експериментально визначив склад повітря і довів, що горіння – це реакція речовини з киснем, а вода – сполука Гідрогену з Оксигеном (1774-1777). Склав першу таблицю простих речовин (1789), запропонувавши фактично класифікацію хімічних елементів. Незалежно від М. В. Ломоносова відкрив закон збереження маси речовин під час хімічної реакції.

У процесі горіння речовин – компонентів паперу – бере участь кисень, який є в повітрі (мал. 51, а). Під час реакції крім твердих речовин попелу утворюються вуглекислий газ і вода (у вигляді пари). Ці дві речовини потрапляють у повітря і розсіюються. Оскільки їхня сумарна маса перевищує масу кисню, то маса попелу завжди буде меншою за масу паперу.
При нагріванні міді кисень повітря “сполучається” з нею (мал. 51, б). Метал поступово перетворюється на речовину чорного кольору (її хімічна формула – СuО, а назва – купрум(ІІ) оксид). Тому маса продукту реакції виявляється більшою за масу міді.
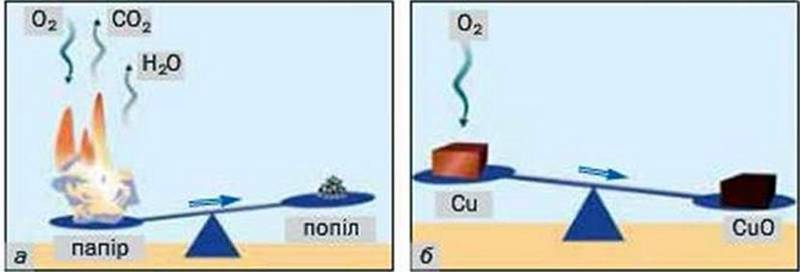
Мал. 51. Реакції речовин паперу (а) і міді (б) з киснем
► Прокоментуйте дослід, зображений на малюнку 52, і зробіть висновок.

Мал. 52. Дослід із підтвердження закону Ломоносова – Лавуазьє: а – початок досліду; б – завершення досліду
Хімічне рівняння. Загальна маса речовин під час хімічної реакції не змінюється внаслідок того, що атоми хімічних елементів не виникають і не зникають. Кількість атомів кожного елемента до реакції дорівнює кількості його атомів після реакції. На це вказують схеми реакцій, наведені на початку параграфа. Замінимо в них стрілки між лівими і правими частинами на знаки рівності:
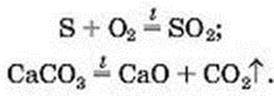
Такі записи називають хімічними рівняннями.
Хімічне рівняння – це запис хімічної реакції за допомогою формул реагентів і продуктів, який відповідає закону збереження маси речовин.
Схеми багатьох реакцій не узгоджуються із законом Ломоносова – Лавуазье. Це, наприклад, стосується схеми реакції утворення води із водню і кисню:
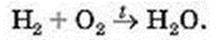
В обох частинах схеми міститься однакова кількість атомів Гідрогену, але різна кількість атомів Оксигену. Перетворимо цю схему на хімічне рівняння. Для того щоб у правій частині було два атоми Оксигену, поставимо перед формулою води коефіцієнт 2:
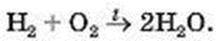
Тепер атомів Гідрогену в правій частині стало чотири. Щоб така сама кількість атомів Гідрогену була і в лівій частині, запишемо перед формулою водню коефіцієнт 2. Отримуємо хімічне рівняння:
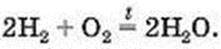
Отже, щоб перетворити схему реакції па хімічне рівняння, потрібно зіставити кількості атомів кожного елемента у лівій і правій частинах схеми, підібрати (у разі необхідності) коефіцієнти для кожної речовини, записати їх перед хімічними формулами і замінити стрілку на знак рівності.
Можливо, хтось із вас складе таке рівняння: 4Н2 + 2О2 = 4Н2О. У ньому ліва і права частини містять однакові кількості атомів кожного елемента, але всі коефіцієнти можна зменшити, поділивши на 2. Це й слід зробити.
ВПРАВА. Перетворити схему реакції Аl + H2SO4 → Al2(SO4)3 + H2↑ на хімічне рівняння.
Розв’язання
У лівій частині схеми реакції міститься один атом Алюмінію, а в правій – два. Запишемо перед формулою металу коефіцієнт 2:
2Аl + H2SO4 → Al2(SO4)3 + H2↑.
Атомів Сульфуру праворуч від стрілки втричі більше, ніж ліворуч. Поставимо в ліву частину схеми перед формулою сполуки Сульфуру коефіцієнт 3:
2Аl + 3H2SO4 → Al2(SO4)3 + Н2↑.
Тепер у лівій частині кількість атомів Гідрогену збільшилась до шести (3 ∙ 2 = 6), а в правій частині таких атомів лише два. Щоб їх і справа було шість, запишемо перед формулою водню коефіцієнт 3:
2Аl + 3H2SO4 -> Al2(SO4)3 + 3H2↑.
Зіставимо кількості атомів Оксигену в обох частинах схеми. Вони однакові: 3 ∙ 4 = 4 ∙ 3. Замінюємо строку на знак рівності й отримуємо хімічне рівняння:
2Al + 3H2SO4 = Al2(SO4)3, + 3H2↑.
ВИСНОВКИ
Хімічні реакції записують за допомогою схем реакцій і хімічних рівнянь.
Схема реакції містить формули реагентів і продуктів, а хімічне рівняння здебільшого – ще й коефіцієнти.
Хімічне рівняння узгоджується із законом збереження маси речовин Ломоносова – Лавуазье: маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції.
Атоми хімічних елементів під час хімічних реакцій не виникають і не зникають.
139. Ним відрізняється хімічне рівняння від схеми реакції?
140. Допишіть пропущені коефіцієнти в хімічних рівняннях:
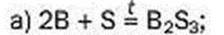
Lі2O + 2HBr = LiBr + Н2O;
6) Аl + НСl = 2АlСl3 + Н2↑;
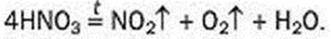
141. Перетворіть на хімічні рівняння такі схеми реакцій:
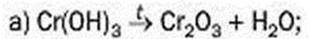
Na + Н2O → NaOH + H2↑;
Б) LiH + Н2O – LiOH + H2↑;
Ва(ОН)2 + Р2O5 → Ва3(РO4)2 + Н2).
142. Складіть формули продуктів реакцій і відповідні хімічні рівняння:
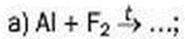
Ca + O2 – …;
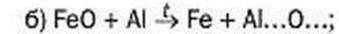
АlВr3 + Сl2 → АlСl… + Вr2.
143. Замість крапок запишіть формули простих речовин і складіть хімічні рівняння:
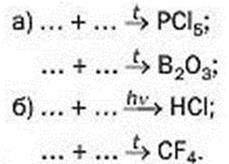
Візьміть до уваги, що бор i вуглець складаються з атомів, фтор, хлор, водень і кисень – із двохатомних молекул, а фосфор (білий) – із чотирьохатомних молекул.
144. Прокоментуйте додаткові позначки в схемах реакцій і складіть відповідні хімічні рівняння:
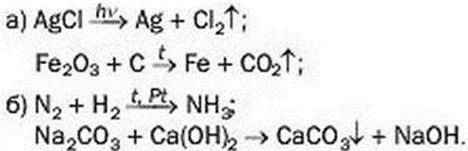
145. Яку масу негашеного вапна було добуто при тривалому прожарюванні 25 г крейди, якщо крім вапна утворилося 11 г вуглекислого газу?