Валентність і ступінь окиснення
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 9. Валентність і ступінь окиснення
Усвідомлення змісту цього параграфа дає змогу:
Пояснювати сучасний зміст понять валентності та ступеня окиснення;
Вміти визначати валентність і ступінь окиснення атомів елементів у сполуках та розмежовувати ці поняття.
Поняття “валентність” було введено в хімію у середині ХІХ ст., раніше, ніж дізналися про будову атома.
Валентність – це здатність атома хімічного елемента приєднувати або заміщувати
Це поняття відіграло неоціненну роль у розвитку хімії. Д. І. Менделєєв, розміщуючи елементи в комірках періодичної системи, використовував валентність як орієнтир у спірних питаннях (яких саме?). О. М. Бутлеров уявлення про валентність поклав в основу класичної теорії хімічної будови. Проте фізичний зміст валентності став відомим лише з розвитком електронної теорії будови атома. Валентністю атома почали вважати число його неспарених електронів у основному або збудженому станах, які беруть участь в утворенні спільних електронних пар з електронами інших атомів, тобто
У результаті збудження атома відбувається розпаровування електронів, і один з 4s2-електронів переходить на вакантну 4р-орбіталь. Валентність Са у збудженому стані дорівнює 2:

У атомів більшості d – та f-елементів на зовнішніх оболонках в основному стані немає неспарених електронів, тому їх валентність дорівнює нулю, незважаючи на те, що на передостанніх d – та f-орбіталях є неспарені електрони. Але вони не можуть утворити електронні пари з електронами інших атомів, оскільки екрануються електронами зовнішньої оболонки.
Оскільки електрони внутрішніх оболонок атома не беруть участі в утворенні хімічних зв’язків, вважали, що максимальна валентність елемента має дорівнювати числу електронів на зовнішній електронній оболонці, отже, номеру групи.
Згодом виявилося, що:
– валентність не завжди відповідає номеру групи періодичної системи, в якій розміщений елемент;
– атоми більшості елементів у неорганічних сполуках можуть утворювати різне число хімічних зв’язків з іншими атомами;
– у багатьох випадках важко визначити валентність елементів (це, наприклад, ферум пентакарбоніл Fe(CO)5, пентаборан B5H9);
– є сполуки, до яких поняття валентності взагалі незастосовне, наприклад інтерметаліди (NaCd5, NaZn12, FeZn7); кристалічні сполуки, що мають йонну будову; сполуки з металічним зв’язком.
Усе зазначене і розвиток електростатичної теорії хімічного зв’язку пояснюють необхідність уведення формального поняття “ступінь окиснення”, яке є загальною характеристикою атомів хімічних елементів. Ступінь окиснення – це умовний заряд, якого набув би атом у речовині, якби спільні електронні пари повністю змістилися б до більш електронегативного атома.
Для визначення ступеня окиснення елемента у сполуці варто пригадати правила, з якими частково ви ознайомилися раніше.
– Ступінь окиснення елемента у простій речовині дорівнює нулю.
– Елементи-метали у сполуках мають позитивні ступені окиснення.
– Гідроген у сполуках має ступінь окиснення +1 (крім гідридів
Металічних елементів  тощо).
тощо).
– Оксиген у сполуках має ступінь окиснення -2 (за винятком
Оксиген флуориду 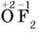 і гідроген пероксиду
і гідроген пероксиду 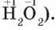
– Ступінь окиснення Флуору в усіх його сполуках становить -1.
– Найвище позитивне значення ступеня окиснення елемента, як правило, дорівнює номеру групи у періодичній системі, де розміщений елемент, а найвище негативне значення – номеру групи мінус 8.
Виняток становлять Флуор, Оксиген, Ферум: найвищий ступінь окиснення атомів цих елементів виражається числом, значення якого нижче за номер групи, до якої вони належать. У елементів ІБ групи, навпаки, найвищий ступінь окиснення більший за одиницю, хоча вони належать до І групи.
Застосовуючи ці правила для визначення ступеня окиснення елемента в сполуці, потрібно пам’ятати, що алгебраїчна сума ступенів окиснення всіх атомів у сполуці завжди дорівнює нулю. Наприклад:
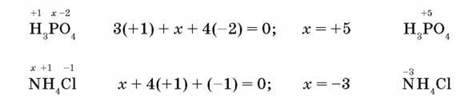
Поняття “ступінь окиснення” використовується в неорганічній хімії для різних практичних і навчальних цілей.
Коротко про головне
Поняття валентності виникло у середині ХІХ ст., і дотепер його зміст постійно розвивається разом з хімічною наукою. Сучасні уявлення про валентність часто ототожнюють із загальним уявленням про хімічний зв’язок, і під валентністю елемента розуміють число спільних електронних пар, які зв’язують атом елемента з іншими атомами.
Поняття валентності застосовується тільки для сполук з ковалентним зв’язком. Для сполук з йонним і металічним зв’язками його застосовувати не можна.
Кількісною характеристикою стану атома в хімічних сполуках нині вважають ступінь окиснення елемента. Це умовний заряд, якого набув би атом у складі хімічної сполуки за умови, що електронні пари, якими він сполучений з іншими атомами, зміщені до більш електронегативних атомів.
Найвищий ступінь окиснення елемента (а не валентність!) дорівнює номеру групи, в якій розміщений елемент (є винятки).
Ступінь окиснення – формальне поняття, однак з другої половини ХХ ст. воно широко використовується у неорганічній хімії як альтернатива поняттю “валентність”.