ВАЛЕНТНІСТЬ ХІМІЧНИХ ЕЛЕМЕНТІВ. СКЛАДАННЯ ФОРМУЛ БІНАРНИХ СПОЛУК ЗА ВАЛЕНТНІСТЮ
Тема 1 ПОЧАТКОВІ ХІМІЧНІ ПОНЯТТЯ
& 17. ВАЛЕНТНІСТЬ ХІМІЧНИХ ЕЛЕМЕНТІВ. СКЛАДАННЯ ФОРМУЛ БІНАРНИХ СПОЛУК ЗА ВАЛЕНТНІСТЮ
Вивчення параграфа допоможе вам:
· зрозуміти сутність поняття валентності;
· навчитись складати формули бінарних сполук за валентністю елементів.
До цього часу ви мали справу з хімічними формулами речовин, які називав учитель, або наведеними у підручнику. Частину з них ви вже запам’ятали.
Запишіть 5 формул і назв відомих вам речовин.
Але речовин надто багато, щоб покладатись лише на запам’ятовування
ЩО НАЗИВАЮТЬ ВАЛЕНТНІСТЮ? Вчених здавна цікавило: чому молекули, що складаються з двох і більше атомів, стоновлять єдине ціле? Чим визначаються кількісні відношення атомів у молекулі? Відповідь на поставлені запитання була запропонована англійським хіміком Е. Франклендом, який увів у науку поняття валентності, що в перекладі з латини означає “сила”.
Валентність – це здатність атомів хімічного елемента сполучатись (утворювати хімічні зв’язки) з певним числом інших атомів.
Деякі атоми мають постійну валентність,
Валентність виражається цілими числами. За одиницю валентності взято валентність Гідрогену, цей елемент одновалентний. Валентність може набувати значень від І до VIІІ.
Проаналізуємо хімічні формули:
1)НСl, 2) Н2О, 3) NН3, 4) СН4.
Гідроген хлорид вода амоніак метан
З першої формули бачимо, що у молекулі гідроген хлориду один атом одновалентного Гідрогену сполучений з одним атомом Хлору, тож Хлор у цій сполуці одновалентний. Друга формула свідчить, що з одним атомом Оксигену у молекулі води сполучені два атоми Гідрогену. Відповідно, розмірковуючи, робимо висновок, що Оксиген – двовалентний. За третьою формулою встановлюємо, що Нітроген в амоніаку – тривалентний, а за четвертою – що Карбон у метані має валентність IV.
Запишемо розглянуті формули, позначивши валентність хімічних елементів над їх символами:
I I | І ІІ | ІІІ I | IV I |
1)HC1 | 2)Н2О | 3)NH3 | 4)CH4 |
У розглянутих прикладах сума одиниць валентності Гідрогену дорівнює валентності іншого елемента. Наприклад, у формулі СH4 сума валентностей Гідрогену 1 ∙ 4 = 4. Це правило поширюється на більшість бінарних сполук (“бі” означає два), тобто утворених двома хімічними елементами.
У бінарній сполуці сума одиниць валентності одного хімічного елемента дорівнює сумі одиниць валентності іншого елемента.
Розглянемо валентність деяких хімічних елементів та навчимося користуватися нею для складання формул бінарних сполук.
ЕЛЕМЕНТИ З ПОСТІЙНОЮ ТА ЗМІННОЮ ВАЛЕНТНІСТЮ. Елементів з постійною валентністю не так уже й багато. Їх приклади наведено в переліку:
І | І | І | І | II | ІІ | II | II | II | ІІІ | ІІІ |
Н, | Na, | F, | K, | Мg, | Са, | Ва, | Zn, | O, | Аl, | В. |
Спробуйте його запам’ятати – це прискорить виконання вами багатьох вправ, пов’язаних зі складанням формул, визначенням валентності елемента в речовині за відомою валентністю інших елементів.
Атоми інших хімічних елементів (їх більшість) мають змінну валентність. Наприклад, у Сульфуру валентність набуває значень Н, IV, VI; у Купруму – І, ІІ; у Феруму – II, ІІІ; у Хлору – І, ІІІ, V, VІІ. Тому у назвах їх сполук після назви символу обов’язково вказують римськими цифрами у круглих дужках значення валентності, наприклад, Сульфур(VІ) оксид має формулу SO3 (мал.64а), яку читають “ес-о-три”. Інша бінарна сполука Сульфуру з Оксигеном SО2 (мал. 64б) вимовляється “ес-о-два” і має назву сульфур(ІV) оксид.
Зверніть увагу, що в розглянутих прикладах змінна валентність елемента пишеться у круглих дужках і без відступу від його назви.
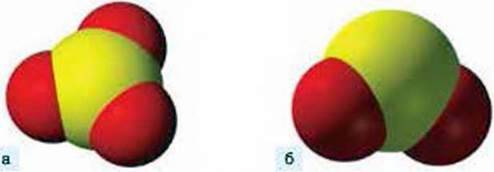
Мал. 64. Моделі сполук Сульфуру з Оксигеном
У назвах складних речовин, утворених елементом зі змінною валентністю, після його символу без відступу записують валентність римською цифрою у круглих дужках.
СКЛАДАННЯ ФОРМУЛ БІНАРНИХ СПОЛУК ЗА ВАЛЕНТНІСТЮ. Складання формул бінарних сполук можна здійснювати у два способи. Послідовність дій у першому способі відображено у таблиці 5.
Таблиця 5
Складання формул бінарних сполук за валентністю
№ | Послідовність дій | Приклади речовин | |
Фосфор(V) оксид | Сульфур (VI) оксид | ||
1 | Записуємо символи хімічних елементів | Р О | SO |
2 | Позначаємо валентність елементів | V II Р О | VI II S O |
3 | Знаходимо найменше спільне кратне (НСК) для одиниць валентності атомів обох хімічних елементів | V II Р О НСК=10 | VI II S O НСК = 6 |
4 | Знаходимо індекси шляхом ділення спільного кратного на валентність кожного елемента | (для Р) 10 : 5 = 2 (для O)10 : 2 = 5 | (для S) 6 : 6 = 1 (для О) 6 : 2 = 3 |
5 | Записуємо знайдені індекси у формулу, пам’ятаючи, що індекс 1 не пишуть | Р2О5 | SO3 |
6 | Здійснюємо перевірку – множимо знайдений індекс на валентність атома | (Р)5 ∙ 2 = 10 (O)2 ∙ 5 = 10 10 = 10 | (S) 1 ∙ 6 = 6 (О) 3 ∙ 2 = 6 6 = 6 |
7 | На підставі тотожності суми одиниць валентності робимо висновок, що формули складено правильно | Р2О5 | SO3 |
Використання другого способу складання формул (назвемо його діaгональним) базується на тому, що у багатьох бінарних сполуках індекс одного елемента збігається з валентністю другого.
Переконайтеся в цьому на прикладах щойно складених формул. Тому після послідовного виконання зазначених у таблиці перших двох дій достатньо валентність першого елемента записати, але не римськими, а арабськими цифрами як індекс другого елемента. Так само, валентність другого елемента записати як індекс першого.
V ІІ
Р2О5
Аналогічно складаючи формулу сульфур(VІ) оксиду, ми мали б написати S2O6. Однак у формулах бінарних неорганічних речовин за невеликим винятком? прикладом якого є гідроген пероксид H2O2 (у медицині його розчин називається “перекис водню”), індекси не бувають парними числами. Тому індекси 2 і 6 скорочуємо вдвоє й одержуємо хімічну формулу сульфур(VI) оксиду – SO3.
Діагональним способом зручно складати формули за валентністю, необхідно лише у разі парних індексів провести їх скорочення.
Потренуємось у використанні діагонального способу складання формул бінарних сполук. Формула сполуки Хлору з Оксигеном містить 5 атомів Оксигену. В Оксигену постійна валентність ІІ, у Хлору – змінна.
Скориставшись діагональним способом, знаходимо індекс Хлору. Він дорівнює валентності Оксигену, тобто 2. Отже, формула сполуки Сl2О5, Хлор у ній п’ятивалентний.
Поняття валентності поширюється й на прості речовини, що мають двохатомні молекули:
І | І | І | II | III |
Н2, | Сl2, | Вr2, | O2, | N2. |
Скарбничка ерудита
Поняття валентності було введено в хімію у 1853 році, тобто майже на півсторіччя раніше, ніж фізикам вдалося з’ясувати склад і будову атома. Відкриття фізиків допомогли розвинути вчення про валентність за рахунок таких понять, як хімічний зв’язок та ступінь окиснення. Їх ви будете вивчати у 8-9 класах.
?
1. Що розуміють під валентністю хімічних елементів?
2. Які ви знаєте елементи з постійною валентністю?
3. Як скласти формулу бінарної сполуки за валентністю хімічних елементів?
4. Складіть формули бінарних сполук елементів та запишіть їх у таблицю, дотримуючись правила, що символи металічних елементів пишуть першими.
Символи елементів | О | Н | N(ІІІ) |
Na | |||
Mg | |||
Аl |
5. Складіть формули бінарних сполук: Йоду (V) й Оксигену; Купруму(І) й Оксигену; Арсену(ІІІ) й Гідрогену, Карбону(ІV) й Сульфуру(ІІ).
6. За складеними у завданні 5 хімічними формулами обчисліть відносні молекулярні маси сполук та масові частки елементів в них.
1. За мал. 65 з’ясуйте, якого кольору кульки використовують для моделювання атомів Гідрогену, Оксигену, Хлору, Нітрогену.
2. Користуючись подібними наборами кульок або кольоровим пластиліном і сірниками, складіть моделі молекул за формулами:
IV
CO, NH3, CCl4, Н2, O2.

Мал. 65. Набір кульок для моделювання молекул та приклади моделей