Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій
ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ
3. Рушійна сила хімічних реакцій
3.4. Вільна енергія реакції Гіббса
Кожна реакція характеризується двома тенденціями:
– система речовин прагне перейти у стан з якомога меншою ентальпією;
– система речовин прагне перейти в стан з якомога більшою ентропією.
Тому реакція

Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. Обидві величини об’єднують у так званому рівнянні Гіббса-Гельмгольца:
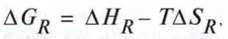
∆GR
∆НR – ентальпія реакції;
∆SR – ентропія реакції;
Т – абсолютна температура.
Реакції, в яких вільна енергія Гіббса знижується, ∆Gr < 0, називають екзоергічними реакціями. Після можливої активації ці реакції проходять самочинно – спонтанні реакції.
Реакції, вільна енергія яких ∆GR > 0, називають ендоергічними реакціями. Ці реакції, незважаючи на можливу активацію, проходять лише при подальшому і постійному надходженні енергії – спонтанно не проходять.
Приклад. Наведена вище реакція гідроген хлориду й амоніаку за стандартних умов
∆G0r = -176,9 кДж/моль – ,
∆G0R = -176,9 кДж/моль + 84,8 кДж/моль = -92,1 кДж/моль.
Отже, реакція відбувається спонтанно з утворенням амоній хлориду.
Зворотна реакція, тобто розкладання амоній хлориду на гідроген хлорид і амоніак, відбуватися за аналогічних умов не буде, вона проходить лише при постійному надходженні енергії.
Related posts:
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНЕРГІЯ ГІББСА. УТВОРЕННЯ РЕЧОВИНИ Стандартною молярною енергією Гіббса утворення речовини ΔG°УТB<298 називають зміну енергії Гіббса при утворенні 1 моль речовини з простих речовин у стандартних умовах. Стандартна молярна енергія Гіббса утворення простої речовини, стійкої у стандартних умовах, дорівнює нулю. Одиниця виміру енергії Гіббса утворення речовини – […]...
- Ентропія простих речовин і сполук – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.2 . Ентропія простих речовин і сполук Прийнято вважати, що атоми елементів і сполук при абсолютному нулі (тобто при 0 К або -273,16 °С) знаходяться в абсолютно впорядкованому стані. Ентропія речовин при абсолютному нулі становить S = 0 Дж/(моль ∙ К). При підвищенні температури порядок у структурі […]...
- ЕНЕРГІЯ ГІББСА – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНЕРГІЯ ГІББСА Щоб однозначно оцінити можливість або неможливість здійснення реакції, необхідно враховувати як зміну ентальпії, так і зміну ентропії. Сумарну зміну ентальпії й ентропії для реакції при сталому тиску і температурі відображає зміна енергії Гіббса: Де ΔG – зміна енергії Гіббса; Т – абсолютна температура. У […]...
- Поняття ентропії – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій Досвід показує, що будь-яка система твердих тіл або речовин завжди прагне перейти у стан з найменшою енергією. Це явище відповідає принципу найменшої енергії. Приклад. Якщо рідку воду винести взимку на холод, то вона перетворюється на твердий лід з виділенням енергії, бо при температурі нижче 0 °С вода […]...
- ЕНЕРГІЯ АКТИВАЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ЕНЕРГІЯ АКТИВАЦІЇ Енергія активації Еа – надлишкова енергія, яку повинні мати молекули, щоб у результаті їхнього зіткнення відбулася хімічна реакція. Хімічна реакція Здійснюється через утворення активованого комплексу А2 … В2, в якому відбувається перегрупування атомів (рис. 44): Рис. 44. Енергетична схема проходження […]...
- РЕАКЦІЇ СПОЛУЧЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ СПОЛУЧЕННЯ Уже сама назва “реакція сполучення” говорить про її тип. У результаті сполучення декількох речовин утворюється одна нова речовина. Практично завжди в реакцію сполучення вступає не більше двох речовин; ці речовини можуть бути як простими, так і складними. Приклади реакцій сполучення: У переважній більшості реакції сполучення є […]...
- Енергетика хімічних реакцій. Тепловий ефект реакції – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.4. Енергетика хімічних реакцій. Тепловий ефект реакції Як відомо із закону збереження енергії, енергія не виникає з нічого і не зникає безслідно. Речовини, що вступають у хімічну реакцію (реагенти), мають певний запас енергії (внутрішньої енергії). Під час хімічної реакції руйнуються […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- РЕАКЦІЇ ЗАМІЩЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ЗАМІЩЕННЯ Реакції між простою і складною речовиною, в результаті яких атоми простої речовини заміщають атоми одного з елементів складної речовини, називаються реакціями заміщення. Наприклад: Рушійною силою реакцій заміщення є утворення більш міцних сполук. З хімічної точки зору чим активніший хімічний елемент, тим міцніші сполуки він утворює, і […]...
- РЕАКЦІЇ РОЗКЛАДУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ РОЗКЛАДУ З назви “реакція розкладу” також випливає, про який тип реакцій іде мова. У реакції розкладу відбувається розкладання складної речовини на декілька речовин. Продуктами реакції можуть бути як прості, так і складні речовини. Наприклад: Майже всі вказані реакції, як і переважна більшість інших реакцій розкладу, ендотермічні. Для […]...
- РЕАКЦІЇ ОБМІНУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ ОБМІНУ Реакції між складними хімічними речовинами, в результаті яких відбувається обмін між ними окремими атомами або групами атомів, називаються реакціями обміну. Наприклад: Реакції обміну (крім сильно екзотермічної реакції нейтралізації) зазвичай супроводжуються невеликим тепловим ефектом, тобто відбувається лише невелика зміна внутрішньої енергії системи, і вона не може бути […]...
- Класифікація хімічних реакцій – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Класифікація хімічних реакцій Класифікація за числом та складом вихідних реагентів і продуктів реакції Реакція сполучення – реакція, внаслідок якої з кількох речовин з відносно простим складом утворюється одна велика речовина з більш складною структурою. А + В […]...
- ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ Швидкість реакції – це кількість речовини, що реагує за одиницю часу. Залежно від умов одна і та ж реакція може протікати з різною швидкістю. Так, при збільшенні кількості речовини, що реагує в одиниці об’єму, тобто його концентрації, швидкість реакції зростає, тому що зростає число зіткнень частинок, що […]...
- Швидкість хімічних реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.1. Швидкість хімічних реакцій Суть хімічних реакцій зводиться до розриву зв’язків у вихідних речовинах і виникнення нових зв’язків у продуктах реакції. При цьому загальне число атомів кожного елемента до і після реакції залишається сталим. Оскільки утворення […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Енергія в проміжних реакціях – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.4 . Енергія в проміжних реакціях Часто зустрічаються реакції, зміну енергії яких експериментально важко або взагалі неможливо визначити. Проте непрямим шляхом ця проблема вирішується: – шукана реакція поділяється на низку проміжних стадій, ентальпія реакцій яких відома; – шукана реакція є однією з проміжних реакцій, сума […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ № 1. Хімічне рівняння – це умовний запис хімічної реакції (хімічного явища) за допомогою хімічних формул, коефіцієнтів і знаків “+” “-” та “=”. Знак “=” вказує на те, що кількість атомів кожного хімічного елемента у лівій та правій частині хімічного рівняння однакова. № 2. Рівняння хімічної реакції відрізняється від її схеми тим, що у рівнянні […]...
- Внутрішня енергія кристалічних речовин – Зміна енергії при кристалізації і розчиненні ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 2 . Зміна енергії при кристалізації і розчиненні У твердому агрегатному стані речовини утворюють, як правило, гратку, в якій частинки впорядковано сполучені між собою. Взаємодія між іонами обумовлена кулонівськими силами, між молекулами – вандерваальсовими силами. 2.1. Внутрішня енергія кристалічних речовин Утворення кристалічної гратки зі складових частинок – це екзотермічний процес. Енергію, яка […]...
- Розрахунки за рівняннями хімічних реакцій між розчином солі та металом РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 53. Розрахунки за рівняннями хімічних реакцій між розчином солі та металом Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть і причини зміни маси пластинки в зазначених реакціях; Розв’язувати задачі “на пластинку”. Задачі такого типу засновані на закономірностях витискувального ряду металів. Як ви уже знаєте, показником порівняльної хімічної […]...
- Хімічні реакції. Класифікація реакцій ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ § 1.8. Хімічні реакції. Класифікація реакцій Речовини, взаємодіючи одна з одною, зазнають різних змін і перетворень. Наприклад, берилій, взаємодіючи з оксигеном повітря за температури понад 500°С, перетворюється на оксид берилію; вугілля, згоряючи, утворює вуглекислий газ […]...
- СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Тема 2 КИСЕНЬ & 24. СХЕМА ХІМІЧНОЇ РЕАКЦІЇ. РІВНЯННЯ ХІМІЧНИХ РЕАКЦІЙ Вивчення параграфа допоможе вам: · пояснювати суть рівнянь хімічних реакцій; · розрізняти схему і рівняння хімічної реакції, коефіцієнти й індекси; · у рівняннях хімічних реакцій розрізняти реагенти і продукти реакцій; · писати рівняння хімічних реакцій з дотриманням закону збереження маси речовин До цього часу […]...
- ЕНТРОПІЯ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЕНТРОПІЯ Ентропію можна охарактеризувати, як ступінь безладдя (невпорядкованості) системи. Ентропію речовини прийнято відносити до стандартних умов: до тиску р = 101 325 Па (1 атм) і, зазвичай, до температури 298 К (25 °С). Ентропія 1 моль речовини у стандартному стані називається стандартною молярною ентропією. Її позначають […]...
- Енергія активації ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.3. Енергія активації Значну зміну швидкості реакції зі зміною температури пояснює теорія активації. Згідно з цією теорією в хімічну взаємодію вступають тільки активні молекули (частинки), що мають енергію, достатню для здійснення даної реакції. Неактивні частинки можна […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
- Енергетичний ефект хімічних реакцій Хімія Загальна хімія Хімічні реакції Енергетичний ефект хімічних реакцій Хімічні реакції завжди супроводжуються виділенням або поглинанням енергії. Кількість виділеної або поглиненої енергії називається тепловим ефектом хімічної реакції (Q). Реакції, що супроводжуються виділенням енергії, називаються екзотермічнимИ, поглинанням енергії, – ендотермічнимИ. Хімічні рівняння, в яких наводяться теплові ефекти хімічних реакцій, називаються ТермохімічнимИ, наприклад: У цьому рівнянні зазначені […]...
- Класифікація хімічних реакцій за різними ознаками Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 21 Тема уроку. Класифікація хімічних реакцій за різними ознаками Цілі уроку: узагальнити й систематизувати знання учнів про хімічні реакції; розвивати вміння й навички визначення типів хімічних реакцій за рівняннями хімічних реакцій; формувати знання учнів про хімічні рівняння на прикладі класифікації рівнянь реакції за тепловим ефектом, наявністю каталізатора, зміною ступенів окиснення […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...