ВЗАЄМОДІЯ ВОДИ З ОКСИДАМИ. ПОНЯТТЯ ПРО ОСНОВИ, КИСЛОТИ, ІНДИКАТОРИ
ДОСЛІДЖУЄМО НА УРОЦІ ТА ВДОМА
ЛАБОРАТОРНИЙ ДОСЛІД 6
Випробування водних розчинів кислот і лугів індикаторами
Речовини та обладнання: пробірки, штатив для пробірок, вода, натрій гідроксид, станова кислота, індикатори.
Завдання 1. Користуючись індикаторами, перевіримо, як змінюються їх кольори у воді, водних розчинах кислоти і лугу. Для цього налили в першу пробірку 1 мл води, у другу – 1 мл розчину етанової кислоти, у третю – 1 мл розчину лугу натрій гідроксиду. По черзі випробуємо їх індикаторами.
Результати спостережень
Натрій гідроксид | Етанова кислота | Вода | Речовина | |
Малиновий | Безбарвний | Безбарвний | Фенолфталеїн | Індикатор |
Жовтий | Рожевий | Оранжевий | Метилоранж | |
Синій | Червоний | Фіолетовий | Лакмус | |
Синій | Червоний | Жовтий | Індикаторний папір |
Висновки
1. Індикатори – це речовини, за допомогою яких визначають кислотність.
2. Для розпізнавання розчинів кислот
№ 1.
Продукти взаємодії води і:
А) оксидів металічних елементів мають назву основи;
Б) оксидів неметалічних елементів мають назву кислоти.
№ 2. Реакції води з оксидами належать до типу реакцій сполучення.
№ 3. Індикатори: фенолфталеїн, метилоранж, лакмус, індикаторний папір.
№ 4.
Розпізнати дослідним шляхом:
А) воду і кислоту можна за допомогою лакмуса: в воді – фіолетовий, в кислоті – червоний;
Б) воду і луг можна за допомогою фенолфталеїна: в воді – безбарвний, в лузі – малиновий;
В) луг і кислоту за допомогою лакмуса: в кислоті – червоний, в лузі – синій.
№ 5. Спільне у формулах усіх основ – наявність групи атомів ОН (гідроксильна група); починаються вони символом металічного елементу, мають загальну формулу Ме(ОН)n.
№ 6. Спільне у формулах усіх кислот – наявність одного або кількох атомів Гідрогену й одного кислотного залишку.
№ 7.
Приклади формул лугів:
Са(ОН)2 – гідроксид кальція;
КОН – гідроксид калія.
Приклади формул кислот:
H2SO4 – сульфатна кислота;
H2SiO3 – силікатна кислота;
Н3Р04 – ортофосфатна кислота;
НСl – хлоридна кислота;
Н2СO3 – карбонатна кислота.
№ 8.
Відповідь: Б.
№ 9.
1 | В |
2 | Б |
3 | Г |
№ 10.
1 | Б |
2 | Г |
3 | А |
4 | В |
№ 11. Напишіть рівняння реакцій за схемами:
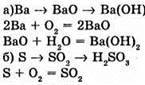
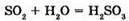
№ 12.
Na2O + H2O = NaOH
BaO + H2O = Ba(OH)2
Довести утворення цих речовин можна за допомогою індикаторів:
Натрій гідроксид, барій гідроксид | Речовина |
Малиновий | Фенолфталеїн |
Жовтий | Метилоранж |
Синій | Лакмус |
Синій | Індикаторний папір |