ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
ХІМІЧНА РІВНОВАГА
Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює
Швидкості його розкладання на SO2 і O2:
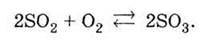
За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту SО3 незначний. При зниженні температури рівновага зміщується вправо і в реакційній
Це – екзотермічна реакція, у ній теплота виділяється, тому при відведенні теплоти (тобто при зниженні температури) рівновага зміщується вправо. Навпаки, підведення теплоти (тобто підвищення температури) перешкоджає протіканню екзотермічної реакції (сполучення) і сприяє протіканню ендотермічної реакції (розкладу SО3), зміщенню рівноваги вліво.
Звідси напрошується висновок, що окиснення діоксиду сульфуру треба проводити, за можливості, за більш низьких температур.
Однак при температурах, нижчих за 800 °С, коли ступінь перетворення досить великий, реакція йде з такою малою швидкістю,
Інший спосіб зміщення хімічної рівноваги – зміна тиску. Він застосовується в реакціях, які супроводжуються помітною зміною об’єму, тобто в реакціях, де змінюється кількість газоподібної речовини. Підвищення тиску сприяє протіканню реакції, яка супроводжується зменшенням об’єму, тобто зменшенням кількості газоподібної речовини.
З огляду на це для реакції окиснення сірчистого газу, у якій із трьох об’ємів газоподібних речовин утворюється два
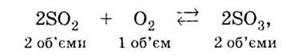
Підвищення тиску викликає зміщення рівноваги вправо.
Підвищення концентрації одного з реагентів збільшує швидкість прямої реакції, тобто зміщує рівновагу вправо.
Підвищення концентрації одного з продуктів збільшує швидкість оборотної реакції, або ж зміщує рівновагу вліво, тому для збільшення виходу продукту застосовують надлишок одного з реагентів, у даному випадку, кисню (у складі повітря).
Related posts:
- АМІАК. АМІАЧНА ВОДА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ АМІАК. АМІАЧНА ВОДА Одна з технічно цінних сполук Нітрогену з Гідрогеном – аміак NН3. У промисловості аміак синтезують із простих речовин: азоту (з повітря) і водню. Це – перший етап зв’язування азоту повітря: Реакція синтезу оборотна. Оскільки вона екзотермічна, то підвищення температури зміщує рівновагу вліво. Реакція супроводжується зменшенням […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Оборотні й необоротні реакції. Хімічна рівновага Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 25 Тема уроку. Оборотні й необоротні реакції. Хімічна рівновага Цілі уроку: формувати уявлення учнів про хімічну рівновагу; ознайомити з класифікацією реакцій на оборотні й необоротні; показати необхідність зсуву хімічної рівноваги; формувати уявлення про фактори, що впливають на зсув хімічної рівноваги. Тип уроку: вивчення нового матеріалу. Форми роботи: фронтальне опитування, самостійна […]...
- Хімічна рівновага – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімічна рівновага Оборотні реакції Часто напрям реакції залежить від умов її проведення. Наприклад, за звичайних умов переважно відбувається реакція: Однак при нагріванні до високої температури майже до тисячі градусів, починає переважати зворотна реакція розкладання кальцій карбонату: Проте […]...
- Хімічна рівновага РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 14. Хімічна рівновага Усвідомлення змісту цього параграфа дає змогу: Пояснювати суть хімічної рівноваги й умови її зміщення, принцип Ле Шательє; Вміти розрізняти оборотні та необоротні реакції, записувати їх рівняння; Керувати хімічними процесами завдяки зміщенню хімічної рівноваги і зміні швидкості хімічних реакцій. Пригадайте, які […]...
- Хімічна рівновага ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.6. Хімічна рівновага Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу аміаку (див. § 10.4) рівновага настає тоді, коли за одиницю часу утворюється стільки само молекул аміаку, скільки їх […]...
- КАТАЛІЗ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ КАТАЛІЗ Швидкість хімічних реакцій визначається, насамперед, природою реагуючих речовин. Змінити природу реагентів не можна. Але можна використовувати якусь речовину, яка взаємодіє з вихідними речовинами за більш низьких температур з утворенням нестійкої сполуки (проміжного продукту), з якої потім утворюється необхідний продукт реакції. Такий спосіб проведення реакції, що полегшує і […]...
- ОКСИДИ НІТРОГЕНУ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ОКСИДИ НІТРОГЕНУ Позитивну валентність Нітроген виявляє у сполуках з Оксигеном – оксидах. При цьому особливістю Нітрогену є те, що він утворює оксиди, які відповідають усім теоретично можливим валентностям від 1 до 5 (зовнішній енергетичний рівень атома Нітрогену містить п’ять електронів). Відповідно існують наступні оксиди нітрогену: N2O, NO, N2O3, […]...
- Розв’язування типових задач ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.8. Розв’язування типових задач Задача 1. Реакція за температури 50° С відбувається за 2 хв 15 с. За який час закінчиться ця реакція за температури 70°С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює З? […]...
- СУЛЬФУР – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФУР Найважливішою сполукою Сульфуру є сульфатна кислота Н2SO4. У якості сировини для виробництва сульфатної кислоти використовуються самородна сірка, а також Сульфур, одержаний при очищенні від його сполук нафти і газу, а ще – сульфіди. Початкова стадія виробництва незалежно від сировини в принципі однакова – випалювання (нагрівання на повітрі): […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- АЗОТ ЯК ПРОСТА РЕЧОВИНА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ АЗОТ ЯК ПРОСТА РЕЧОВИНА Молекула N2 – найміцніша з усіх молекул відомих простих речовин, це – взагалі одна з найміцніших молекул (енергія хімічного зв’язку вища тільки в молекулі СО), тому у природі Нітроген знаходиться, в основному, у вигляді простої речовини N2 – однієї з основних складових частин повітря, […]...
- НІТРАТНА КИСЛОТА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ НІТРАТНА КИСЛОТА Найважливішою сполукою Нітрогену є нітратна кислота НNO3. У ній Нітроген проявляє свою вищу валентність +5, як і у відповідному кислотному оксиді N2O5. Для одержання нітратної кислоти у промисловості використовують реакцію: Нітратна кислота (безводна) за звичайних умов є безбарвною рідиною, яка, як і сульфатна кислота, змішується з […]...
- СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ У творений при окисненні діоксиду сульфуру триоксид сульфуру – кислотний оксид. Під час його взаємодії з водою утворюється сульфатна кислота Н2SO4: Безводна сульфатна кислота – рідина, густина якої майже у два рази перевищує густину води. Вона змішується з водою у будь-яких пропорціях. Процес […]...
- ФОСФОР I ЙОГО СПОЛУКИ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ФОСФОР I ЙОГО СПОЛУКИ Радіус атома Фосфору майже у два рази більший, ніж Нітрогену. Це зумовлює суттєві відмінності у їхніх властивостях. Різниця в розмірах атомів позначається уже в будові простих речовин. Молекули азоту, утворені маленькими атомами, двохатомні. Збільшення розміру атомів веде до менш ефективного перекривання їх атомних орбіталей […]...
- СТАН ХІМІЧНОЇ РІВНОВАГИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА СТАН ХІМІЧНОЇ РІВНОВАГИ Умова здійснення хімічної рівноваги: ΔH = ТΔS. За умови хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції. Стан рівноваги характеризує константа рівноваги К. Для системи За значенням константи рівноваги можна робити висновки про глибину протікання реакції: Перша реакція порівняно з другою протікає практично […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.2 . Зміна тиску Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок. Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2 2NH3. Кількість частинок […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- ОКСИДИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. КИСЛОТНИЙ ХАРАКТЕР ОКСИДІВ І ГІДРАТІВ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 8. ОКСИДИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. КИСЛОТНИЙ ХАРАКТЕР ОКСИДІВ І ГІДРАТІВ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Цілі: формувати знання про оксиди неметалічних елементів, їх добування і властивості, формули й характер відповідних їм гідратів та вміння складати формули сполук і хімічні рівняння, що характеризують властивості й добування оксидів неметалів. Обладнання: роздавальний матеріал, […]...
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- КАТАЛІЗ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ КАТАЛІЗ Каталіз – це зміна швидкості хімічної реакції речовинами (каталізаторами), які беруть участь у реакції, але не входять до складу кінцевих продуктів. За участю каталізатора хімічна рівновага системи досягається швидше, ніж без нього. Вплив у каталізатора на швидкість реакції досягають за рахунок […]...
- Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота I СЕМЕСТР Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.) УРОК 8 Тема уроку. Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота Цілі уроку: розширити знання про хімічні властивості неметалів на прикладі їхніх сполук із Гідрогеном, знання про властивості кислот на прикладі гідроген хлориду та хлоридної кислоти, властивості хлоридів; продовжити формування практичних умінь […]...
- Принцип Ле Шательє ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.7. Принцип Ле Шательє Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску (для газових реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівноваги, або принципу Ле Шательє: Якщо на систему, […]...
- Зміна ступеню окиснення – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.5. Зміна ступеню окиснення Процес віддачі електронів атомом, молекулою або йоном називають окисненням. Атоми, молекули або йони, що віддають електрони, називають відновниками. Під час реакцій вони окислюються: Процес приєднання електронів атомом, молекулою або йоном називають відновленням. Атоми, молекули або йони, […]...
- ЕНЕРГІЯ АКТИВАЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ЕНЕРГІЯ АКТИВАЦІЇ Енергія активації Еа – надлишкова енергія, яку повинні мати молекули, щоб у результаті їхнього зіткнення відбулася хімічна реакція. Хімічна реакція Здійснюється через утворення активованого комплексу А2 … В2, в якому відбувається перегрупування атомів (рис. 44): Рис. 44. Енергетична схема проходження […]...
- Типи окисно-відновних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.7. Типи окисно-відновних реакцій Розрізняють 3 типи окисно-відновних реакцій: міжмолекулярні, внутрішньо-молекулярні та реакції диспропорціонування. 1. Міжмолекулярні окисно-відновні реакції У таких реакціях елемент, що віддає електрони, та елемент, що їх приєднує, містяться в складі різних молекул. Наприклад: 2. Внутрішньо-молекулярні окисно-відновні реакції […]...
- Хімічна символіка. Знаки хімічних елементів та хімічні формули Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ ЗАКОНИ Й ПОНЯТТЯ ХІМІЇ Хімічна символіка. Знаки хімічних елементів та хімічні формули До хімічної символіки відносять символи хімічних елементів, хімічні формули й рівняння. Символи хімічних елементів складаються з однієї або двох букв латинського алфавіту з числа тих, які входять до складу латинської […]...