ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ. РЕАКЦІЯ СПОЛУЧЕННЯ
Тема 2 КИСЕНЬ
& 27. ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ. РЕАКЦІЯ СПОЛУЧЕННЯ
Вивчення параграфа допоможе вам:
· називати склад і наводити приклади оксидів;
· характеризувати хімічні властивості кисню;
· складати рівняння реакцій за участю кисню;
· розрізняти реакції розкладу і сполучення;
· пояснювати суть реакцій сполучення
Вам відомо, що хімічні властивості речовин це їх здатність взаємодіяти з іншими речовинами. Взаємодія завершується тим, що із структурних частинок, які входили до складу реагентів,
ВЗАЄМОДІЯ КИСНЮ З ПРОСТИМИ РЕЧОВИНАМИ.
1. Взаємодія я вуглецем. Розжаримо на полум’ї спиртівки вуглинку і внесемо її у наповнену киснем колбу. Вуглинка швидко згоряє, не утворюючи кіптяви та диму (мал. 87, а), а стінки колби нагріваються. Наллємо у колбу вапняної води, вона помутніє. А це доводить, що у колбі, де раніше містився кисень, з’явився вуглекислий газ.
Виділення світла й тепла свідчать
С + О2 = СО2 – вуглекислий газ, або карбон(ІV) оксид (1)
2. Взаємодія з воднем. До наповненої воднем сухої пробірки піднесемо запалений сірник. Відразу почуємо приглушений хлопок. Це тому, що водень реагує з киснем миттєво – з вибухом. Поява на стінках сухої пробірки крапельок води – переконливий доказ утворення цієї речовини:
2H2 + O2 = 2H2О – вода, або гідроген оксид (2)
3. Взаємодія з сіркою. Наповнимо ложечку для спалювання речовин на 1/3 сіркою, внесемо в полум’я спиртівки й потримаймо, доки сірка не розплавиться й не почне горіти. Після цього внесемо ложечку в колбу з киснем. Сірка відразу спалахує яскравим синім полум’ям, колба наповнюється сірчистим газом (мал. 87, б):
S + O2 = SO2 – сірчистий газ, або сульфур (ІV) оксид (3)
Цю реакцію супроводжує поява різкого специфічного запаху сірчистого газу.
4. Взаємодія з магнієм. Підпалимо магнієву стрічку, і вона швидко згорить яскраво-сліпучим полум’ям:
2Mg + О2 = 2MgO – магній оксид (4)
Видимою нам ознакою цієї хімічної реакції є поява світла.
5. Взаємодія із залізом. Спробуємо, подібно магнію, спалити тоненьку залізну голку. Зробити це у повітрі нам не вдасться. Перевіримо, чи згорить голка у колбі, наповненій киснем. Для безпечного проведення досліду дно колби покриємо шаром піску. Устромимо тоненьку голку тією її частиною, де розташоване вушко, у дерев’яну паличку й на вістря голки наколемо сірник. Відразу після підпалювання сірника повільно внесемо голку в колбу з киснем. Залізо швидко загоряється, утворений продукт реакції яскравими іскрами, що нагадують новорічні бенгальські вогні, розлітається в різні боки (мал. 87, в). Від голки залишається маленька оплавлена кулька у місці її закріплення. Стінки колби нагріваються. Це хімічне явище передається таким рівнянням реакції:
3Fe + 2O2 = Fe3O4 залізна окалина (б)
Реакція супроводжується виділенням світла й тепла.
6. Взаємодія з міддю. Мідну пластинку потримаємо кілька хвилин над полум’ям спиртівки. Спостерігатимемо, як замість червоно-мідного кольору з’являється чорний:
2Сu + O2 = 2СuО – купрум(II) оксид (в)
Реакція супроводжується зміною кольору.
ПОНЯТТЯ ПРО ОКСИДИ. У всіх щойно розглянутих реакціях утворювалися бінарні сполуки елемента з Оксигеном – оксиди.
До простих чи складних речовин належать оксиди? Відповідь поясніть.

Мал. 87. Горіння в кисні вугілля (а), сірки (6) та заліза (в)
Ви вже знаєте, що оксидами називають бінарні сполуки елементів з Оксигеном та вмієте визначати валентність хімічного елемента в оксиді. Пригадати це можна” звернувшись до параграфа 18.
Продукт взаємодії заліза з киснем – залізна окалина Fe3O4 – особлива бінарна сполука Оксигену. Вона утворена з двох оксидів – FeO і Fe2O3.
Визначте за формулами обох оксидів. у якому з них металічний елемент Ферум двовалентний, а в якому – тривалентний.
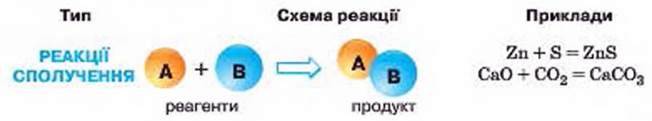
РЕАКЦІЯ СПОЛУЧЕННЯ. У кожному з шести розглянутих прикладів спільним було те, що з двох речовин утворювалася одна. Такі реакції належать до реакцій сполучення.
Реакції, в результаті яких з двох чи більше речовин утворюється одна речовина, називають реакціями сполучення.
Щоб після розглянутих прикладів у вас не склалося враження, що сполучатися можуть лише прості речовини, наведемо приклади рівнянь реакцій сполучення складної і простої речовини; двох складних речовин:
2СО + О2 = 2СО2 (7)
Na2O + SО3= Nа3SO4 – натрій сульфат (8)
Як бачимо, головним для реакцій сполучення є те, що утворюється один продукт реакції, а реагенти можуть бути і складними, і простими речовинами, але їх неодмінно має бути два чи більше.
Узагальнимо вивчене:
ВЗАЄМОДІЯ КИСНЮ ЗІ СКЛАДНИМИ РЕЧОВИНАМИ. Взаємодія з метаном. Щоразу, запалюючи газову плиту, люди здійснюють хімічну реакцію між метаном СН4 (основна складова частина природного газу) та киснем:
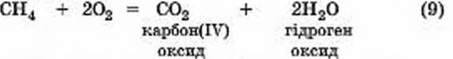
Це хімічне явище супроводжується двома фізичними явищами світловим та тепловим. Під час його перебігу вміст кисню у приміщенні кухні зменшується, а вуглекислого газу, навпаки, збільшується. Тому правильно діють ті, хто провітрює кухню, тримає відчиненою кватирку, встановлює електричні витяжки.
Взаємодія кисню з гідроген сульфідом H2S. Гідроген сульфід, або сірководень, також згоряє у кисні. За достатньої кількості кисню реакція супроводжується утворенням уже відомого вам сірчистого газу та води:
2Н2S + 3О2 = 2 SО2 + 2Н2О (10)
Повне окиснення глюкози C6Н12О6. Вже одне те, що без дихання людина може прожити не більше 5-7 хвилин, наводить на думку про надзвичайну важливість кисню для організму. А чи задумувалися ви над тим, які функції кисню у нашому організмі? Адже його добова норма не така вже й мала – близько 700 г.
Учені дослідили, що за участю кисню в організмі відбувається багато реакцій. Зокрема глюкоза, яка надходить до організму людини з продуктами харчування, теж реагує з киснем. Взаємодія відбувається в присутності ферментів (каталізаторів) і завершується утворенням вуглекислого газу і води. Це можна виразити таким сумарним рівнянням реакції:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О (11)
У всіх розглянутих прикладах незалежно від того, проста чи складна речовина взаємодіє з киснем, утворюються оксиди тих елементів, які входили до складу реагентів. Проте, при неповній взаємодії складної речовини з киснем може утворитися і проста речовина. Наприклад, розглянута вище взаємодія кисню з гідроген сульфідом Н2S може відбуватися з утворенням сірки та води, якщо кисню взято з недостачею:
2Н2S + О2 = 2S + 2Н2О (12)
Кисень належить до активних речовин. Він легко вступає у взаємодію з простими і складними речовинами. Продуктами цих реакцій є оксиди.
Скарбничка ерудита
На початку параграфа було сказано, що більшість простих речовин взаємодіє з киснем. Прикладами металів, що не входять у цю більшість, є золото Au, платина Pt, тому їх називають благородними металами. Серед неметалів “байдужість”, або інертність, до кисню виявляють гелій Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе і радон Rn. Тому ці газоподібні речовини мають загальну назву інертні гази.
Тривалий час у науці вважалося, що інертні гази не взаємодіють ні з якими речовинами. Однак за останнє півстоліття вдалося добути деякі їх сполуки, в тому числі й з Оксигеном, правда не за реакцією сполучення інертного газу з киснем, а іншими способами.
?
1. З чого складаються оксиди? Наведіть приклади оксидів.
2. Схарактеризуйте хімічні властивості кисню.
3. Які реакції називають реакціями сполучення? Наведіть приклади.
4. У чому полягає відмінність між хімічними реакціями розкладу та сполучення?
5. Випишіть з тексту параграфа формули і назви речовин, які для вас є новими.
6. За формулами оксидів, що наявні у тексті параграфа, визначте, який з них має найменшу, а який – найбільшу маcову частку Оксигену.
7. За наведеними схемами напишіть рівняння реакцій:
А) Ва + О2 -> ВаО
Б) PbS + О2 -> РbО + SO2
В) Сu + O2 -> СuО
Г) HgS + О2 -> Hg + SO2
8. Напишіть рівняння реакцій кисню з:
А) амоніаком NH3, якщо в утвореному оксиді валентність Нітрогену дорівнює 2;
6) цинк сульфідом ZnS, якщо в утвореному оксиді валентність Сульфуру дорівнює IV.
З’ясуйте розташування інертних газів у періодичній системі хімічних елементів Д. І. Менделєєва.