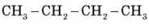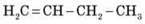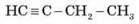Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів
УРОК 2
Тема. Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів
Цілі: з’ясувати суть понять “ізомерія”, “ізомери”, “структурна ізомерія”, причини багатоманітності органічних речовин, правила міжнародної номенклатури; навчитися складати формули ізомерів парафінів, давати їм назви за міжнародною номенклатурою, виготовляти куле-стрижневі моделі ізомерів парафінів.
Обладнання: ПМК “Органічна хімія. 10-11 класи”, ПСХЕ, набори для виготовлення куле-стрижневих моделей.
Тип уроку: ВНМ(О).
Форми
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й мети уроку
III. Актуалізація опорних знань
На початку уроку необхідно актуалізувати знання про основні класи вуглеводнів.
Метод “Мозковий штурм”
– Вуглеводні з одним подвійним зв’язком називаються…
– Вуглеводні з одним потрійним зв’язком називаються…
– Вуглеводні з одинарними зв’язками називаються…
– Загальна формула алканів…
– Загальна формула алкінів…
–
– Речовина складу С2Н6 називається…
– Речовина складу С2Н2 називається…
– Речовина складу С5Н12 називається…
– Формула пентіну…
– Формула бутену…
– Формула гексану…
Пропонуємо учням скласти структурні формули останніх трьох речовин.
На основі повтореного складаємо узагальнюючу схему:
Алкани | Алкени | Алкіни | |
Загальна формула | CnH2n+2 | CnH2n | CnH2n-2 |
Суфікс | -ан | -ен | -ін |
Хімічні зв’язки | Одинарні
| Один подвійний
| Один потрійний
|
IV. Мотивація навчальної діяльності
Проблемне питання. У чому причини багатоманітності органічних речовин?
Чи може одній формулі відповідати декілька речовин з різною будовою?
V. Вивчення нового матеріалу
Лекція вчителя з елементами бесіди.
На дошці записані основні поняття теми:
– Теорія хімічної будови органічних речовин.
– Ізомери.
– Ізомерія.
– Структурна ізомерія.
– Міжнародна номенклатура.
– Радикал.
1. Нагадуємо учням про існування двох різних речовин з формулою С4Н10.
Пропонуємо записати їх структурні формули на дошці й у зошитах. Звертаємо увагу на те, що четвертий атом Карбону приєднаний не з краю, а всередині молекули, так щоб утворилася принципово нова будова молекули.
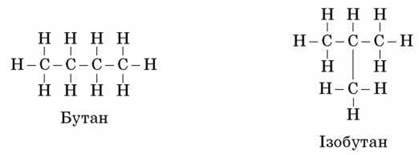
2. Далі пропонуємо учням об’єднатися в групи по чотири особи та спробувати записати ізомери пентану.
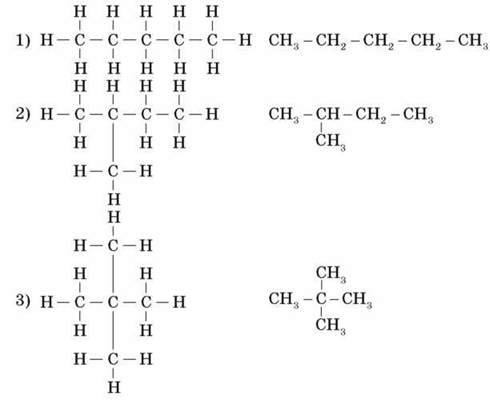
3. Пропонуємо учням скласти куле-стрижневі моделі цих речовин. Це надасть дітям змогу зрозуміти порядок побудови молекул ізомерів.
4. Перевіряємо роботу груп. Якщо треба, пояснюємо принципи складання ізомерів:
1) спочатку будуємо каркас (скелет) молекули;
2) скорочуємо ланцюг спочатку на один атом Карбону і кріпимо цей атом усередину молекули;
3) додаємо атоми Гідрогену згідно з валентністю Карбону(ІV);
4) пояснюємо, що якщо атоми Карбону об’єднані в ланцюг без відгалужень, то такі вуглеводні називаються нерозгалужені, а якщо атоми Карбону відходять угору, вниз від основного ланцюжка, тобто розгалужуються, то такі вуглеводні називають розгалуженими.
5. Уводимо поняття:
– “ізомерія” – явище існування речовин з однаковою молекулярною формулою, але різним порядком з’єднання атомів у молекулі, а тому й різними властивостями;
– “структурна ізомерія” – вид ізомерії, пов’язаний зі зміною будови карбонового ланцюга;
– “ізомери” – речовини, які мають однакову молекулярну формулу, але різний порядок з’єднання атомів у молекулі, а тому й різні властивості.
6. Даємо поняття про номенклатуру органічних речовин. Пояснюємо.
Кожна речовина має дві назви – тривіальну (ужиткову) та міжнародну (систематичну). Систематичну номенклатуру запропонувала Міжнародна спілка теоретичної та прикладної хімії – ІЮПАК. Правила номенклатури насичених вуглеводнів – алканів (парафінів) – такі:
1) У молекулі вибирають найдовший ланцюг і починають нумерувати його з того боку, де ближче стоїть радикал-замісник. Радикал – це хімічно активна частинка, яка утворюється з молекули насиченого вуглеводню, коли він відщеплює один атом Гідрогену. Наприклад: метан СН4 утворює радикал СН3- – метил, етан С2Н6 утворює радікал С2Н5- – етил, і т. д.
2) Цифрою вказують положення радикала-замісника в ланцюжку. Наприклад, 2-метил означає, що від другого атома Карбону відходить радикал метил СН3-. А якщо однакових радикалів декілька, то цифрою вказують кожний з них (2,3,4-), але перед назвою радикала ставлять префікс – ди-, три-, тетра – і т. д. Наприклад: 2,3,4-триметил – (три радикали СН3-, які відходять від 2, 3 і 4 атома Карбону в основному ланцюзі), 2,3,5,7-тетра (чотири). Отже, префікс, указує скільки однакових радикалів містить молекула.
3) Якщо радикали стоять біля одного й того самого атома Карбону, то цифру вказують двічі. Наприклад, 2,2-диметил, 2,3,3-триметил і т. д.
4) Якщо радикали різні, то називати їх починають за алфавіту: спочатку етил, метил, пропіл тощо.
5) Остаточну назву речовині дають за кількістю атомів Карбону в нумерованому ланцюзі, не забуваючи, що всі алка – ни мають суфікс – ан.
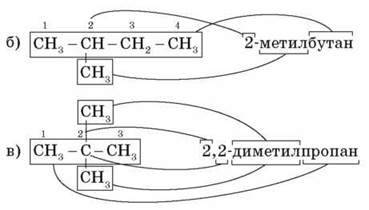
Розглянемо ці правила на ізомерах пентану.
А) СН3-СН2-СН2-СН2-СН3
Н-пентан (н – нормальний, нерозгалужений)
VI. Усвідомлення та закріплення знань
“Творча лабораторія”
Учні продовжують роботу в групах і вчаться називати парафіни.
1) Спробуємо назвати речовину.
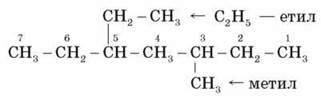
Знайдемо та пронумеруємо найдовший ланцюг з того боку, де ближче радикал. А у нас два радикали на однаковій відстані від обох боків, тому вибираємо той, що простіше, тобто метил, і нумеруємо з його боку, але називати починаємо за алфавітом з радикала етилу. Отже, отримуємо назву:
5-етил-3-метилгептан.
2) Назвіть речовини:
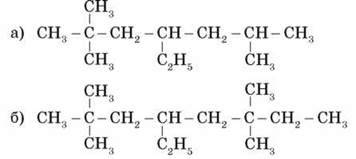
3) Складіть структурну формулу речовин з назвою:
А) 4-етил-3,3-диметилгептан;
Б) 3-етил-2,3,5-триметилнонан.
VII. Підбиття підсумків уроку
VIII. Домашнє завдання