Зміна тиску – Чинники, що впливають на зміщення хімічної рівноваги
ХІМІЧНА РІВНОВАГА
2 . Чинники, що впливають на зміщення хімічної рівноваги
2.2 . Зміна тиску
Реакції рівноваги, в яких беруть участь гази, часто супроводжуються зміною кількості частинок.
Приклад. При синтезі амоніаку з простих речовин реагують між собою 3 моль водню і 1 моль азоту та утворюється 2 моль амоніаку: 3Н2 + N2  2NH3.
2NH3.
Кількість частинок зменшується, відповідно, вдвічі.
Тому в такій замкнутій системі залежно від умов реакції спостерігається зміна тиску або зміна об’єму.
Приклад. Якщо синтез
Стан рівноваги може змінюватися в результаті підвищення тиску ззовні:
– підвищення тиску досягається шляхом збільшення кількості початкових речовин при постійному об’ємі;
– при змінному об’ємі шляхом стискування.
При підвищенні тиску в замкнутій системі рівновага зміщується в бік меншої кількості частинок.
Приклад. При синтезі амоніаку підвищення тиску викликає зміщення рівноваги в бік утворення продуктів реакції.
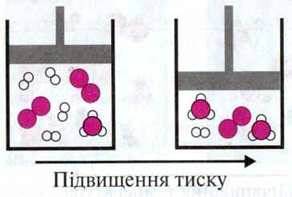
Запам’ятайте: у реакціях, в яких кількість частинок не змінюється, зміна тиску не викликає зміщення рівноваги.
Related posts:
- Принцип зміщення рівноваги – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.4 . Принцип зміщення рівноваги Усі чинники, що впливають на хімічну рівновагу, можна об’єднати таким чином: Увага: зміна тиску впливає на рівновагу лише в замкнутій системі. Поведінка системи, яка знаходиться в хімічній рівновазі по відношенню до зовнішніх впливів тиску і температури, визначається спільним принципом: […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- Визначення констант рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.3. Визначення констант рівноваги Знаючи концентрації речовин, що знаходяться в стані рівноваги, можна обчислити відповідну константу рівноваги. Приклад. Початкова кількість речовини n0 = 1 моль гідроген йодиду в реакції з утворенням водню і йоду при температурі Т = 446 °С розпалася n = 0,22 моль (н. у.). Відповідно до […]...
- ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА ЗМІЩЕННЯ ХІМІЧНОЇ РІВНОВАГИ. ПРИНЦИП ЛЕ ШАТЕЛЬЄ Якщо система, що знаходиться в рівновазі, піддається зовнішньому впливу, рівновага зміщується у напрямку послаблення цього впливу. Відповідно до принципу Ле Шательє під час нагрівання рівновага зміщується у бік ендотермічної реакції; при підвищенні тиску – у бік реакції, яка проходить зі зменшенням […]...
- Стан рівноваги – Константа рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги 1.2 . Константа рівноваги У ході реакції рівноваги первинна концентрація початкових речовин постійно зменшується. Внаслідок цього знижується і швидкість прямої реакції. Одночасно постійно підвищується концентрація продуктів реакції. Внаслідок цього підвищується швидкість зворотної реакції. Для бімолекулярної реакції типу можна скласти наступні вирази швидкості прямої та зворотної реакції: Коли швидкості обох […]...
- Реакції рівноваги – Характеристики хімічної рівноваги ХІМІЧНА РІВНОВАГА 1. Характеристики хімічної рівноваги Багато хімічних реакцій оборотні. В якому напрямі вони проходитимуть залежить від наявних умов, наприклад, від температури. 1.1. Реакції рівноваги В оборотних реакціях за певних і постійних умов можуть проходити як пряма, так і зворотна реакції. Приклад. Суміш газоподібного йоду і водню реагує при підвищеній температурі, утворюючи гідроген йодид. Н2 […]...
- СТАН ХІМІЧНОЇ РІВНОВАГИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА РІВНОВАГА СТАН ХІМІЧНОЇ РІВНОВАГИ Умова здійснення хімічної рівноваги: ΔH = ТΔS. За умови хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції. Стан рівноваги характеризує константа рівноваги К. Для системи За значенням константи рівноваги можна робити висновки про глибину протікання реакції: Перша реакція порівняно з другою протікає практично […]...
- Внутрішня енергія кристалічних речовин – Зміна енергії при кристалізації і розчиненні ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 2 . Зміна енергії при кристалізації і розчиненні У твердому агрегатному стані речовини утворюють, як правило, гратку, в якій частинки впорядковано сполучені між собою. Взаємодія між іонами обумовлена кулонівськими силами, між молекулами – вандерваальсовими силами. 2.1. Внутрішня енергія кристалічних речовин Утворення кристалічної гратки зі складових частинок – це екзотермічний процес. Енергію, яка […]...
- Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Приклади розв’язування типових задач І. Швидкість хімічної реакції Формули і поняття, які використовуються: Де v1 – швидкість прямої реакції, V2 – швидкість зворотної реакції, A, Б – реагенти реакції, B, Г – продукти реакції, С(А), с(Б) – концентрації реагентів, С(В), […]...
- Принцип Ле Шательє ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.7. Принцип Ле Шательє Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску (для газових реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівноваги, або принципу Ле Шательє: Якщо на систему, […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ЗАКОН ГЕССА. РОЗРАХУНОК ЕНТАЛЬПІЇ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції залежить від початкового і кінцевого станів системи і не залежить від шляху реакції (закон Гесса). Наприклад: Кількість теплоти, яка виділяється під час спалювання метану СН4, не залежить від того, протікає реакція за одну стадію чи за дві […]...
- Розв’язування типових задач ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.8. Розв’язування типових задач Задача 1. Реакція за температури 50° С відбувається за 2 хв 15 с. За який час закінчиться ця реакція за температури 70°С, якщо в даному температурному інтервалі температурний коефіцієнт швидкості дорівнює З? […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- ХІМІЧНА РІВНОВАГА – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ ХІМІЧНА РІВНОВАГА Реакція окиснення діоксиду сульфуру – оборотна. Це означає, що через деякий час після початку реакції в системі встановлюється рівновага: швидкість утворення SО3 дорівнює Швидкості його розкладання на SO2 і O2: За високої температури переважно протікає реакція розкладу (рівновага зміщена вліво), і в рівноважній суміші вміст продукту […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Хімічна рівновага – Хімічні реакції Хімія Загальна хімія Хімічні реакції Хімічна рівновага Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотнимИ. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються НеоборотнимИ. Умови необоротності хімічних реакцій 1) Продукти, що утворюються, виводяться зі сфери реакції – випадають у вигляді осаду, […]...
- ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ – ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ХІМІЧНА КІНЕТИКА. ШВИДКІСТЬ І МЕХАНІЗМ ХІМІЧНИХ РЕАКЦІЙ ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ Швидкість і механізм хімічної реакції вивчає хімічна кінетика. Швидкість хімічної реакції характеризується зміною концентрації однієї з вихідних речовин або кінцевих продуктів за одиницю часу. Середня швидкість реакції: Де с1 і с2 – початкова і кінцева концентрація речовини; τ1 і […]...
- Швидкість хімічної реакції. Каталізатор – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.8. Швидкість хімічної реакції. Каталізатор Розділ хімії, що вивчає швидкість хімічних реакцій, називають хімічною кінетикою. Розгляньмо зміст деяких понять, які використовують у цьому розділі. Швидкість хімічних реакцій характеризується зміною концентрації реагентів (або продуктів реакції) за одиницю часу. Якщо реакції відбуваються […]...
- Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VIIA ГРУПИ § 22. Обчислення за рівнянням хімічної реакції, якщо один з реагентів узято в надлишку Усвідомлення змісту цього параграфа дає змогу: розв’язувати задачі на надлишок. Розглянемо рівняння реакції водню з хлором: За яким водень масою 2 г реагує з хлором масою 71 г з утворенням […]...
- Зміна атмосферного тиску з висотою РОЗДІЛ II ВЗАЄМОДІЯ ТІЛ УРОК № 16/29 Тема уроку. Зміна атмосферного тиску з висотою Тип уроку: комбінований. Мета уроку: продовжити формувати в учнів уявлення про атмосферу, показати її значення для нашої планети, як на практиці застосовуються знання з цієї теми; навчати розв’язувати типові задачі, аналізуючи фізичні явища. Обладнання: рідинний і металевий манометри. План уроку Етапи […]...
- ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ВПЛИВ ТЕМПЕРАТУРИ НА НАПРЯМОК ХІМІЧНОЇ РЕАКЦІЇ Згідно з рівнянням На значення ΔG великий вплив має температура. Цей вплив визначається знаком і величиною ΔS. При ΔS > 0 з підвищенням температури (збільшенням Т) негативне значення ΔG буде зменшуватися, а при ΔS < 0 – збільшуватися. Приклад реакції, […]...
- Хімічна рівновага – Оборотність хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.9. Оборотність хімічних реакцій За цією ознакою розрізняють: – реакції, які за однакових умов відбуваються у двох протилежних напрямках, називають оборотними. Наприклад, реакція синтезу сульфур(VI) оксиду (знак вказує саме на оборотність реакції): – необоротними називають реакції, які відбуваються тільки в […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ РІВНЯННЯ ХІМІЧНОЇ РЕАКЦІЇ Хімічний процес як перетворення одних речовин в інші описується за допомогою рівняння хімічної реакції. При складанні рівняння варто враховувати, що число атомів кожного елемента зліва і справа повинно бути однаковим (адже в рівнянні вказано знак рівності), тому перед формулами речовин-реагентів і речовин-продуктів ставляться числові […]...
- Хімічні основи виробництва аміаку – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.4. Хімічні основи виробництва аміаку Теорія синтезу аміаку з простих речовин досить складна. Тут лише зазначаються оптимальні умови процесу, що грунтуються на принципі зміщення хімічної рівноваги. Оскільки ця реакція екзотермічна, то при зниженні температури рівновага зміщуватиметься в […]...
- Урок 27-28. Рельєф. Чинники, що впливають на формування рельєфу Урок 27-28. Рельєф. Чинники, що впливають на формування рельєфу Мета: розширити й уточнити уявлення учнів про рельєф, визначити чинники, що впливають на формування рельєфу; продемонструвати принцип роботи з нівеліром; продовжити формувати навички роботи з контурною картою; розвивати просторові уявлення про географічні об’єкти, вміння перекладати теоретичні знання на практичну діяльність. Обладнання: фізична карта світу, фізична карта […]...
- Тема 4. Закономірності перебігу хімічних реакцій – ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ОСНОВНІ ПОНЯТТЯ, ЗАКОНИ І ЗАКОНОМІРНОСТІ В ХІМІЇ Тема 4. Закономірності перебігу хімічних реакцій Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте назву реакцій, що перебігають з виділенням теплоти: A. Ендотермічні; Б. Оборотні; В. Необоротні; Г. Екзотермічні. 2. Позначте вірне […]...
- ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Хімія – універсальний довідник КІЛЬКІСНІ ВІДНОШЕННЯ В ХІМІЇ ОДИНИЦЯ КІЛЬКОСТІ РЕЧОВИНИ – МОЛЬ Речовини, що вступають в хімічну взаємодію, можуть складатися з атомів, або молекул, або інших частинок. Кількість речовини, що реагує, зручно характеризувати числом таких частинок. Одиницею кількості речовини, що визначає число частинок, з яких ця речовина складається, є моль. Кількість речовини, виражена в […]...