Агрегатні стани речовини
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ
4.2. Агрегатні стани речовини
Речовина залежно від термодинамічних параметрів – тиску, об’єму і температури – може перебувати в трьох агрегатних станах: твердому, рідкому та газоподібному. Крім того, речовина за певних умов може бути в стані плазми. Сучасні агрегатні стани дещо нагадують чотири стихії давніх: Земля – твердий стан, вода – рідкий стан, повітря – газоподібний стан, вогонь – плазму.
Будова
Гази і кристали відрізняються будовою і характером молекулярного руху. Гази характеризуються хаотичністю, кристали – впорядкованістю у розміщенні молекул. У цьому розумінні гази і кристали мають протилежні властивості. У рідинах діалектично поєднуються ці протилежні властивості. Молекули газів рухаються поступально, а молекули кристалів коливаються навколо нерухомих положень рівноваги. Молекули рідин коливаються подібно до молекул кристалів, але положення рівноваги, відносно яких відбуваються коливання, не залишаються нерухомими, як у кристалах, а час від часу зміщуються. У рідині виступають в єдності порядок, характерний для кристалів, і безпорядок, характерний для газів. Молекули рідини не так міцно зв’язані одна з одною, як молекули твердих тіл, але взаємодія між ними значно більша, ніж у газоподібному стані. Молекули рідини можуть долати ці сили зв’язку. За певної температури молекули рідини мають різну швидкість і та чи інша молекула може набути достатньої енергії для подолання сил зв’язку. Якщо рух молекули напрямлений до поверхні рідини, то вона може вийти з неї. Цей процес називається випаровуванням. Він може відбуватися за будь-якої температури. Такі міркування можна застосувати також для твердого тіла, щоб пояснити можливість випаровування твердих тіл без попереднього перетворення в рідину. Це явище називають сублімацією.
Густина газу за нормальних умов значно менша, ніж густина тієї самої речовини в рідкому стані: 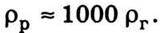 Зв’язок відстаней між частинками для газу і рідини такий:
Зв’язок відстаней між частинками для газу і рідини такий: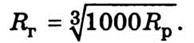 Довжина вільного пробігу молекул у газоподібному стані λ = 10-7 м, середня швидкість руху молекул газу за кімнатної температури 400…500 м/с. Розміри одного атома близько 10-10 м, молекули – 3 ∙ 10-10 м. Середня густина атомів у Сонячній системі становить 109 атомів/м3, у Галактиці – 106 атомів/м3, поза межами Галактики – 105…106 атомів/м3.
Довжина вільного пробігу молекул у газоподібному стані λ = 10-7 м, середня швидкість руху молекул газу за кімнатної температури 400…500 м/с. Розміри одного атома близько 10-10 м, молекули – 3 ∙ 10-10 м. Середня густина атомів у Сонячній системі становить 109 атомів/м3, у Галактиці – 106 атомів/м3, поза межами Галактики – 105…106 атомів/м3.
За законом Авогадро, якщо будь-які два гази займають однакові об’єми при однаковому тиску і мають однакові температури, то в цих об’ємах міститься однакове число молекул. Із цього закону випливає, що молі будь-яких речовин у газоподібному стані при однакових тисках і однакових температурах займають однакові об’єми. Число молекул у молі будь-якої речовини NA = 6,02 ∙ 1023 моль-1. Це число називається числом Авогадро. Дослід засвідчує, що моль будь-якої речовини в газоподібному стані за нормальних умов займає об’єм 22,4 ∙ 10-3 м3. Звідси можна визначити число молекул газу, що міститься за нормальних умов у 1 см3. Це число називається числом Лошмідта і дорівнює 2,7 ∙ 1019 см-3.
Закон Дальтона для суміші газів формулюється так: тиск суміші газів дорівнює сумі парціальних тисків газів, які утворюють суміш. Парціальним тиском називається тиск, який мав би газ, коли б він один заповнював увесь об’єм.