Алюміній. Алюміній оксид, алюміній гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 30
Тема уроку. Алюміній. Алюміній оксид, алюміній гідроксид, їх амфотерність. Солі Алюмінію. Використання найважливіших сполук Алюмінію
Цілі уроку: розширити й поглибити знання учнів про метали на прикладі Алюмінію – представника головної підгрупи ІІІ групи; повторити поняття амфотерності на прикладі сполук Алюмінію, їх хімічних властивостей; показати поширення алюмінію в природі, застосування Алюмінію та його сполук.
Тип уроку: комбінований урок засвоєння
Форми роботи: семінар, фронтальна робота.
Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва, таблиця розчинності, колекція “Алюміній та його сплави”.
Демонстрація 4. Одержання алюміній гідроксиду та його амфотерні властивості.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
Найпоширеніший у земній корі метал – алюміній (5,5 %) – існує в природі лише у вигляді сполук.
1. Складіть схему будови атома Алюмінію.
2. У чому полягають відмінності в будові
3. Назвіть характерну валентність, ступінь окиснення, які Алюміній проявляє в сполуках.
4. Чим пояснюється зниження хімічної активності алюмінію порівняно з Na, K, Ca?
ІІІ. Вивчення нового матеріалу
Семінар за планом
1. Положення Алюмінію в періодичній системі, будова його атома
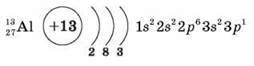
2. Фізичні властивості алюмінію
Сріблясто-білий метал, легкий і пластичний, ? = 2,7 г/см3, tпл = 660 °С.
Легко витягується в дріт, прокочується в листи й фольгу. За електропровідністю поступається лише сріблу й міді. Входить до складу легких сплавів.
3. Природні сполуки Алюмінію
– Каолініт Al2O3 – 2SiO2 – 2H2O, входить до складу глини.
– Корунд Al2O3, кристали: червоні (рубіни), сині (сапфіри).
– Польовий шпат K2O – Al2O3 – 6SiO2.
– Боксит Al2O3 – nH2O.
– Нефелін Na2O – Al2O3 – 2SiO2.
– Кріоліт Na3[AlF6].
4. Способи одержання
Одержують електролізом Al2O3 у розплавленому кріоліті за температури близько 1 000 °С.
5. Хімічні властивості Алюмінію
1) Взаємодія з неметалами.
(Пропонуємо учням по ланцюжку дописати рівняння реакцій на дошці.)
Легко з’єднується з галогенами за кімнатної температури:
Al + Cl2 =
У результаті нагрівання:
Al + S =
Al + N2 =
Al + O2 = – сліпучий спалах.
2) Алюмінотермія:
Cr2O3 + 2Al = Al2O3 + 2Cr
3) З водою не взаємодіє, поверхня металу захищена оксидною плівкою, але якщо зняти її, протікатиме реакція:
Al + H2O =
(Допишіть ОВP.)
4) Алюміній легко взаємодіє з розчинами кислот.
Завдання. Допишіть рівняння реакцій окиснення-відновлення:
Al + HCl =
Al + HNO3 =
Al + H2SO4 (конц.) =
5) Реагує з лугами за нагрівання:
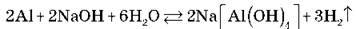
(Розставити коефіцієнти методом електронного балансу.)
6. Алюміній оксид Al2O3
Біла тугоплавка речовина, нерозчинна у воді, t = 2 050 °С.
Проявляє амфотерні властивості:
Al2O3 + HCl =
Al2O3 + NaOH =
Запишіть іонно-молекулярні рівняння.
7. Алюміній гідроксид Білий драглистий осад.
Демонстрація 4. Одержання алюміній гідроксиду та його амфотерні властивості
Al2(SО4) + 6NaОH = 2Al(ОH)3 + 3Na2SО4
Доведіть рівняннями хімічних реакцій амфотерність Al(OH)3.
Al(ОH) + HCl =
Al(OH)3 + NaOH = NaAlО2 + 2H2О (у процесі сплавлення)
Al(ОH)3 + NaOH = Na[Al(ОH)4] (у розчинах)
8. Солі Алюмінію
Тверді, білі речовини, дуже гідролізовані.
9. Застосування Алюмінію та його сполук
– Сплави.
– Алюмінотермія.
– Алюмінієві вироби.
IV. Закріплення вивченого матеріалу
Узагальнення вчителя, заповнення опорної схеми
V. Тренувальні вправи
Самостійна робота зі схемами
Обчисліть масу кінцевого продукту, якщо для реакції взяли 5,4 г алюмінію.
VI. Підбиття підсумків уроку
– У чому причина відмінності між властивостями Алюмінію, Кальцію й Калію?
– Як можна пояснити ці відмінності з огляду на будову їхніх атомів?
– Чому алюміній має широке застосування в побуті, техніці, металургії?
– Чому в природі алюміній не трапляється в самородному стані?
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання.
Випереджальні завдання
1. Положення Феруму в періодичній системі, будова атома.
2. Фізичні властивості заліза.
3. Природні сполуки Феруму.
4. Виробництво чавуну та сталі.
5. Хімічні властивості Феруму:
А) взаємодія з простими речовинами;
Б) взаємодія з водою й кислотами.
6. Ферум(ІІ) і ферум(ІІІ) оксиди, їх властивості.
7. Ферум(ІІ) гідроксид, його властивості.
8. Ферум(ІІІ) гідроксид, його амфотерні властивості.
9. Застосування заліза та сполук Феруму.