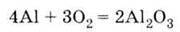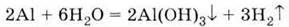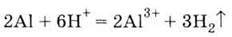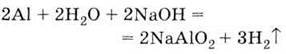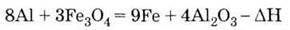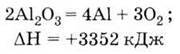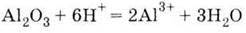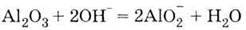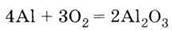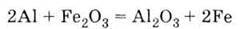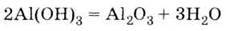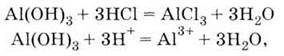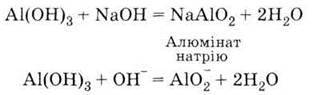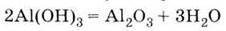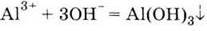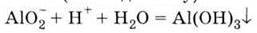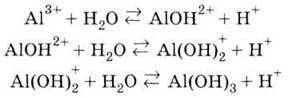АЛЮМІНІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
АЛЮМІНІЙ
Алюміній – третій за поширеністю елемент земної кори. Він входить до складу багатьох силікатних мінералів, які називаються алюмосилікатами. Найважливішою природною сполукою алюмінію, що стала сировиною для виробництва металу, є боксит 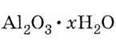 – гідратований оксид алюмінію.
– гідратований оксид алюмінію.
Алюміній – дуже активний метал. У ряді активності металів він стоїть лівіше багатьох інших металів, тому використовується для промислового одержання деяких
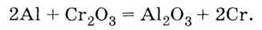
Метод одержання металів з їх оксидів за допомогою алюмінію називається алюмінотермією. Найважливіша сполука Алюмінію – оксид Аl2О3. Він володіє амфотерністю, що виявляється у взаємодії його і з кислотами, і з основами:
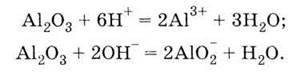
Алюміній одержують розкладанням електричним струмом розчину його оксиду у роз плавленому кріоліті ЗNaF – АlF3:
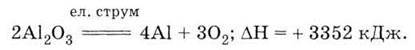
Через високу енергію хімічного зв’язку в оксиді алюмінію процес його розкладу надзвичайно
Таблиця
Алюміній і його сполуки
Алюміній | Сполуки Алюмінію | |
Оксид алюмінію | Гідроксид алюмінію | |
1. Сріблясто-білий легкий метал 2. Окислюється на повітрі з утворенням захисної оксидної плівки:
3. Витісняє водень з води:
4. Взаємодіє з кислотами:
5. Взаємодіє з лугами:
6. Витісняє метали з їх оксидів (алюмінотермія):
Одержання Розклад електричним струмом розплаву оксиду алюмінію (у кріоліті):
| 1. Дуже твердий порошок білого кольору 2. Амфотерний гідроксид, взаємодіє: З кислотами
З лугами:
Утворення А) при окисненні або горінні алюмінію на повітрі:
Б) у процесі алюмінотермії:
В) при термічному розкладанні гідроксиду алюмінію:
| 1. Білий нерозчинний у воді порошок 2. Проявляє амфотерні властивості, взаємодіє: З кислотами:
З лугами:
3. Розкладається при нагріванні:
Утворення А) при взаємодії розчинів солей алюмінію з розчинами лугів (без надлишку):
Б) при взаємодії алюмінатів з кислотами (без надлишку):
Солі алюмінію у водних розчинах гідролізуються:
|
Проте і сам алюміній, і його сплави широко застосовуються у промисловості, і масштаби застосування цього металу постійно зростають. Це зумовлено рядом чинників. Перерахуємо найважливіші з них.
1. Алюміній – найпоширеніший метал земної кори. Його ресурси практично невичерпні.
2. Алюміній має високу корозійну стійкість, і вироби з нього практично не потребують спеціального захисту.
3. Невелика густина алюмінію (2,7 г/см3) у поєднанні з високою міцністю і пластичністю його сплавів робить алюміній незамінним конструкційним матеріалом у літакобудуванні і сприяє розширенню його застосування в наземному і водному транспорті, а також у будівництві.
4. Відносно висока електропровідність алюмінію дозволяє замінювати ним в електротехніці значно дорожчу мідь.
5. Висока хімічна активність алюмінію використовується в алюмінотермії.
6. Міцність хімічного зв’язку в оксиді А12O3 зумовлює його механічну міцність, твердість. Природний оксид алюмінію, корунд, – один з основних абразивних матеріалів. Штучний рубін – оксид алюмінію з домішками хрому (для надання забарвлення) є обов’язковими деталями механічних годинників (осі і підшипники; чим більше “каменів” у годинниках, тим вони кращі).
Хімічні властивості алюмінію і його сполук наведено у таблиці, наданої вище.