Алюміній як хімічний елемент і проста речовина
РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ІА – ІІІА ГРУП
§ 65. Алюміній як хімічний елемент і проста речовина
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати Алюміній за місцем у періодичній системі та електронною будовою атома, поширеність у природі; фізичні та хімічні властивості, добування, застосування його простої речовини; складати рівняння, схеми електронного балансу відповідних реакцій;
Оцінювати біологічну роль.
Алюміній як хімічний елемент. Його назва походить від латинського
Алюміній – хімічний елемент ІІІА групи. Згідно з місцем Алюмінію в ІІІА групі періодичної системи на зовнішньому енергетичному рівні його атома містяться три валентні електрони, електронна конфігурація яких 3s23р1. Алюміній – металічний р-елемент. У хімічних реакціях атоми Алюмінію легко втрачають три електрони і перетворюються на тризарядні катіони:
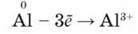
У сполуках завжди ступінь
Поширеність у природі. Алюміній – третій елемент за поширенням у природі після Оксигену та Силіцію: його атомна частка в земній корі становить 6,4 %. Трапляється завжди в складі сполук, переважно алюмосилікатів (мал. 119).
Біологічна роль. Алюміній разом із Силіцієм та Оксигеном є основою неорганічного світу, у невеликій кількості трапляється в живих організмах: 50 – 140 мг у людини масою 70 кг. Розподіляється в усіх тканинах й органах: серці, легенях, мозку, трубчастих кістках, волоссі тощо; впливає на активність деяких ферментів. Його надлишок, запобігаючи надходженню до кісток Фосфору, спричиняє так званий алюмінієвий рахіт кісток.
Алюміній як проста речовина. Це сріблясто-білий метал (мал. 120), досить легкоплавкий (tпл = 660 °С), дуже легкий (р = 2,7 г/см3), але твердий (твердість 2,5). Має високу електропровідність, однак поступається в цьому міді.


Мал. 119. Природні сполуки Алюмінію: а – боксит Al2O3 – nH2O; б – каолініт Al2O3 – 2SiO2 – 2H2O; в – кріоліт Na3[AlF6]; г – польовий шпат К20 – Al2O3 – 6SiO2; г – нефелін Na2O – Al2O3 – 2SiO2

Мал. 120. Алюміній
Завдяки надзвичайній пластичності добре піддається механічній обробці: прокатується у фольгу завтовшки до 0,01 мм, витягується в тонкий дріт, відливається; утворює сплави.
Належить до хімічно активних металів. У витискувальному ряді металів міститься на початку, за магнієм. Як активний метал алюміній реагує з неметалами, водою, кислотами. Немета – лічний характер його властивостей виявляється в реакціях з лугами. У всіх реакціях виконує роль відновника.
Однак як на повітрі, так і у воді алюміній не виявляє прогнозованої хімічної активності, бо його поверхня вкрита оксидною плівкою Al2O3, яка захищає метал від подальшого окиснення і зумовлює його високу корозійну стійкість. Хоча товщина цієї плівки становить лише 1 10-5 мм, вона міцна, тверда і гнучка, не руйнується при розтягуванні, закручуванні та згинанні, проводить електричний струм, плавиться за температури 2050 °С (порівняйте з температурою плавлення алюмінію). Надає поверхні алюмінію матового вигляду.
Взаємодія з неметалами. Алюміній легко реагує з неметалами (галогенами, киснем, сіркою, азотом, вуглецем), особливо в порошкоподібному стані. Утворюються відповідно оксид, галогеніди, нітрид, карбід. Для початку реакцій необхідне попереднє нагрівання за винятком реакцій з галогенами. Зате далі перебіг реакцій дуже бурхливий, з виділенням великої кількості теплоти. Пригадайте реакцію алюмінію з йодом, з якою ви ознайомилися під час вивчення властивостей галогенів:
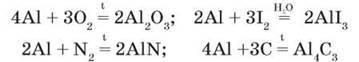
Взаємодія з водою. Алюміній стійкий до дії води, навіть киплячої, завдяки оксидній плівці на його поверхні. Якщо цю плівку зруйнувати (потерти поверхню алюмінію наждачним папером або занурити ненадовго в гарячий розчин лугу), то алюміній активно взаємодіятиме з водою з виділенням водню. На малюнку 121 бачимо дві пробірки: у першій – виділення водню на початку реакції, у другій – утворення осаду Аl(ОН)3 після закінчення реакції:
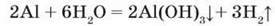
– Складіть схеми електронного балансу.
Взаємодія з оксидами металічних елементів. Алюміній взаємодіє з оксидами більшості металічних елементів, навіть лужних:
2Al + 3К2О = Аl2О3 + 6К; 8Al + 3Fe3O4 = 4Аl2О3 + 9Fe

Мал. 121. Реакція алюмінію з водою
Усі речовини цих реакції перебувають у твердому стані, тому до реакції не можна застосувати відоме правило витискувального ряду металів. У цьому випадку реакція стає можливою завдяки міцності кристалічної гратки алюміній оксиду. При її утворенні виділяється значна кількість енергії і температура досягає 3500 °С, що є достатньою для руйнування кристалів іншого оксиду і відновлення металу. За цих умов відновлений метал перебуває у рідкому стані, а алюміній оксид спливає на поверхню у вигляді шлаку.
Суміш порошкоподібних алюмінію та оксиду металічного елемента називається термітом (від грец. терме – теплота), а спосіб добування металів – алюмотермією. Цим способом добувають хром, манган, титан тощо.
Спосіб добування металів за допомоги алюмінію запропонував у середині ХІХ ст. відомий учений М. М. Бекетов.
Взаємодія з кислотами. За стандартних умов алюміній взаємодіє з кислотами – хлоридною і розбавленою сульфатною, відновлюючи Гідроген й утворюючи солі:
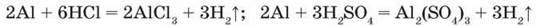
Варто пам”ятати, що концентрована сульфатна кислота і будь-якої концентрації нітратна кислота на холоді пасивують алюміній: під дією цих кислот збільшується товщина оксидної плівки, і метал не взаємодіє з ними. Ось чому ці кислоти можна зберігати і перевозити в алюмінієвих цистернах.
Однак при нагріванні реакції відбуваються:
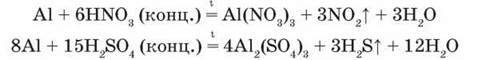
Взаємодія з лугами. Алюміній легко розчиняється у водних розчинах лугів, виділяючи водень залежно від молярного співвідношення речовин:
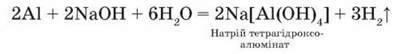
Ця реакція застосовується для добування в лабораторії водню й застерігає не зберігати луги в алюмінієвому посуді.
Добування. У промисловості алюміній добувають електролізом розчину алюміній оксиду в розплавленому кріоліті Na3l(AlF6)з добавкою кальцій флуориду. Алюміній оксид Al2O3 добувають із бокситу та нефеліну.
Порошкоподібний алюміній уперше добув німецький хімік Ф. Велер (1827). Лише 18 років по тому він одержав алюміній у вигляді маленьких гранул. Новий метал був схожим на срібло, але легшим. Такі цінні властивості зумовили його вартість: з середини ХІХ ст. алюміній цінували більше, ніж золото.
Технічно доступним металом алюміній став після того, як був знайдений спосіб зниження температури плавлення алюміній оксиду за допомоги кріоліту Na3[AlF6]. Алюміній почали добувати у великих кількостях, тому він швидко здешевшав. Нині за обсягом виробництва серед металів алюміній посідає друге місце після заліза.
Застосування. Основна маса алюмінію йде на виготовлення алюмінієвих сплавів: дюралюміній, силумін для авіаційної та космічної техніки, водного і наземного транспорту. З алюмінію виготовляють електричні дроти, освітлювальні ракети, посуд, застосовують для добування металів. Порошок алюмінію є пігментом для фарби (“срібнянки”), яка захищає залізо від корозії. Алюмінієву фольгу використовують у радіотехніці для виготовлення конденсаторів, як обгортковий матеріал – у харчовій промисловості.
Коротко про головне
Алюміній – металічний елемент ІІІА групи періодичної системи. Має три валентні електрони. У реакціях виявляє лише відновні властивості. Ступінь окиснення Алюмінію в сполуках +3. Його оксид і гідроксид є амфотерними.
За поширенням у природі Алюміній посідає третє місце після Оксигену та Силіцію. Трапляється в складі сполук, переважно алюмосилікатів.
Проста речовина алюміній – це сріблясто-білий метал, легкоплавкий, легкий, пластичний, добре проводить теплоту та електричний струм. Є хімічно активним металом. Спосіб відновлення оксидів металічних елементів алюмінієм називається алюмотермією.
Алюміній добувають електролізом розплаву його оксиду Al2O3 у кріоліті Na3[AlF6]. Знаходить широке застосування.