Будова атома
АТОМНА І ЯДЕРНА ФІЗИКА
12 уроків
– Ядерна модель атома
– Квантові постулати Бора
– Лінійчасті й безперервні спектри
– Ядерні сили і їхні особливості
– Ланцюгова реакція ділення ядер Урану
– Елементарні частинки
Тематичне планування
№ з/п | Тема уроку | Дата проведення |
1 | Будова атома | |
2 | Теорія атома Бора | |
3 | Лабораторна робота № 6 “Спостереження суцільного й лінійчастого | |
4 | Лазери | |
5 | Атомне ядро | |
6 | Ядерні сили | |
7 | Радіоактивні перетворення | |
8 | Ядерні реакції | |
9 | Енергія зв’язку | |
10 | Ядерна енергетика | |
11 | Елементарні частинки | |
12 | Тематичне оцінювання з теми “Атомна і ядерна фізика” |
УРОК 1/50
Тема. Будова атома
Мета уроку: розповісти учням про будову атома; ознайомити їх із планетарною моделлю атома за Резерфордом.
Тип
ПЛАН УРОКУ
Демонстрації | 5 хв. | 1. Таблиці: схема досліду Резерфорда; планетарна модель атома. 2. Відео-фрагмент фільму “Дослід Резерфорда” |
Вивчення нового матеріалу | 30 хв. | 1. Модель атома Томсона. 2. Досліди Резерфорда. 3. Планетарна модель атома. 4. Недоліки планетарної моделі атома |
Закріплення вивченого матеріалу | 10 хв. | 1. Навчаємося розв’язувати задачі. 2. Контрольні питання |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Модель атома Томсона
До 1902 р. було здійснено достатньо експериментів, які переконливо довели, що електрон є однією з основних складових частин будь-якої речовини.
Джозеф Джон Томсон показав на основі класичної електромагнітної теорії, що розміри електрона повинні бути близько 10-15 м. Крім того, було відомо, що розміри атомів становлять кілька ангстрем (один ангстрем дорівнює 10-10 м). На цій підставі Томсон 1903 р. запропонував модель атома, відповідно до якої атоми являють собою однорідні кулі з позитивно зарядженої речовини, у якій перебувають електрони. Сумарний заряд електронів дорівнює позитивному заряду атома. Тому атом загалом електрично нейтральний. Ця модель одержала назву “пудинг”, тому що електрони були вкраплені в позитивно заряджене середовище подібно до родзинок у пудингу.
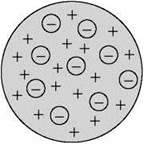
Відхилення електрона в атомі від положення рівноваги призводить до виникнення обертальної сили. Тому електрон, виведений у певний спосіб з положення рівноваги, здійснює коливання, а тому є джерелом електромагнітного випромінювання.
Модель Томсона здавалася привабливою з того погляду, що передбачала наявність електронів в атомі. Однак вона проіснувала тільки до 1911 року.
2. Досліди Резерфорда
Резерфорд запропонував своїм співробітникам експериментально перевірити заможність моделі атома Томсона. Ідея досліду була проста. Якщо модель атома Томсона відповідає дійсності, то, пропускаючи через дуже тонку металеву плівку вузький пучок швидких?-частинок, експериментатори не повинні виявити скільки-небудь помітного відхилення цих частинок.
Резерфорд установив, що кожна?-частинка, потрапляючи на екран із сірчистого цинку, спричиняє спалах світла. Розсіявшись у золотій фользі, ?-частинки потрапляли потім на екран, і їх потім реєстрував мікроскоп.
Варто було сподіватися, що пучок?-частинок під час проходження через тонку фольгу злегка розпливеться на незначні кути. Таке розсіювання на малі кути дійсно спостерігалося, але зовсім зненацька виявилося, що приблизно одна?-частинка з 20 000, що падають на золоту фольгу завтовшки всього лише 4-10-5 см, повертається назад, у бік джерела.
Резерфорду знадобилося кілька років, щоб остаточно зрозуміти настільки несподіване розсіювання?-частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об’ємі в центрі атома, а не розподілений по всьому атомі, як у моделі Томсона.
3. Планетарна модель атома
Резерфорд зумів визначити розмір атомного ядра. І виявилося, що атомне ядро в десятки тисяч разів менше за власне атом: розмір ядра – близько 10-14 -10-15 м, в той час як розмір атома – близько 10-10 метрів.
Грунтуючись на своїх дослідах і розрахунках, Резерфорд запропонував планетарну модель атома:
– атоми будь-якого елемента складаються з позитивно зарядженої частини, що дістала назву ядра;
– до складу ядра входять позитивно заряджені елементарні частинки – протони (пізніше було встановлено, що й нейтральні нейтрони);
– навколо ядра обертаються електрони, що утворюють так звану електронну оболонку.
Подібність атома до Сонячної системи посилювалося тим, що закон Кулона, що “керує” рухом електронів, збігається за формою із законом всесвітнього тяжіння, що “керує” рухом планет: і в тому, і в іншому випадку сила обернено пропорційна квадрату відстані.
4. Недоліки планетарної моделі атома
Попри всю переконливість планетарної моделі виникав цілий ряд нездоланних труднощів під час пояснення будови атома. Відповідно до класичної теорії, система, що складається з масивного позитивно зарядженого ядра й легких, негативно заряджених електронів, може бути стійкою тільки в тому випадку, коли електрони перебувають у русі. Таким чином, атом мав бути подібним до мініатюрної Сонячної системи, у якій роль Сонця відіграє ядро, а планет – електрон.
Аналогія була б досить повною (адже електричні й гравітаційні сили залежать від відстані, як 1/r2), якби не одне передбачення класичної теорії, відповідно до якого електричні заряди, що прискорено рухаються, повинні випромінювати енергію у вигляді електромагнітних хвиль. Тому електрони, рухаючись по “планетарних” орбітах, повинні були б під час випромінювання втрачати енергію руху й у результаті швидко наближатися до ядра. Розрахунки показували, що електрон в атомі Гідрогену має випромінювати всю свою енергію за малу частку секунди. Однак в атомі цього не відбувається.
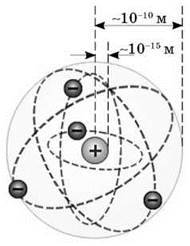
З іншого боку, якби електрони рухалися навколо ядра подібно до планет навколо Сонця, то кожний атом був би єдиним у своєму роді, тому що, відповідно до класичної механіки, кожний електрон міг би рухатися за кожною з нескінченної кількості орбіт. І тому мала б спостерігатися нескінченна розмаїтість атомів того самого хімічного елемента.
Таким чином, в “атомних масштабах” суперечить досвіду не тільки класична електродинаміка, але й класична механіка – основа основ всієї класичної фізики.
ПИТАННЯ ДО УЧНІВ У ХОДІ ВИКЛАДУ НОВОГО МАТЕРІАЛУ
Перший рівень
1. Чому негативно заряджені частинки атома не мають помітного впливу на розсіювання?-частинок?
2. Чому а-частинки не могли б розсіюватися на великі кути, якби позитивний заряд атома був розподілений по всьому його об’єму?
3. Які частинки входять до складу ядра?
4. Чим відрізняються один від одного атоми різних хімічних елементів?
Другий рівень
1. На підставі яких експериментальних даних Резерфорд сформулював планетарну модель атома?
2. Чому планетарна модель атома не узгоджується із законами класичної фізики?
3. Що є головною характеристикою певного хімічного елемента?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Якісні питання
1. У що перетворюється атом Натрію, якщо з його ядра “забрати” один протон, не змінюючи кількості електронів?
2. Скільки протонів, нейтронів і електронів у позитивному іоні Літію?
2). Навчаємося розв’язувати задачі
1. У ядрі атома Карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів?
2. Чи буде змінюватися кількість?-частинок, розсіяних під певним кутом, якщо в досліді Резерфорда збільшити товщину фольги удвічі?
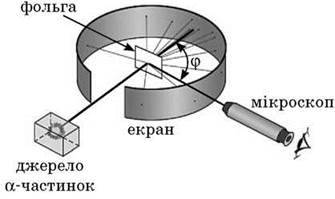
Схема досліду Резерфорда
ЩО МИ ДІЗНАЛИСЯ НА УРОЦІ
Планетарна модель атома:
– атоми будь-якого елемента складаються з позитивно зарядженої частини, що дістала назву ядра;
– до складу ядра входять позитивно заряджені елементарні частинки – протони (пізніше було встановлено, що й нейтральні нейтрони);
– навколо ядра обертаються електрони, що утворюють так звану електронну оболонку.
Домашнє завдання
Підр.: § 27 (п. 1).