Діаграма стану речовини
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ
4.3. Діаграма стану речовини
Графічна залежність тиску від температури для певної кількості речовини при сталому об’ємі називається діаграмою стану. Загальний вигляд такої діаграми зображено на рис. 4.1. Для більшості речовин діаграма стану має вигляд, зображений на рис. 4.1 суцільними лініями, а для води та речовин, об’єм яких збільшується при переході з рідкого до твердого стану, – штриховою лінією.
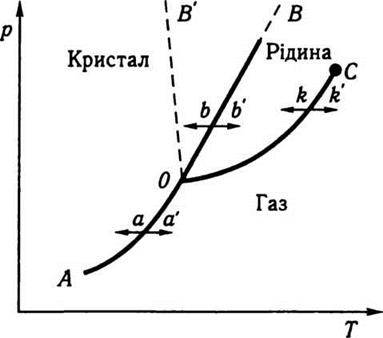
Рис. 4.1
Крива ОВ називається кривою плавлення, ОС – кривою випаровування, ОА – кривою сублімації. Всі ці криві можна назвати також кривими співіснування кристал – рідина (ОВ), рідина – пара (ОС), кристал – газ (ОА). Точка С називається критичною точкою, або, за Д. І. Менделєєвим, точкою абсолютного кипіння. В критичній точці зникає відмінність між рідиною і газом. За температури, вищої від критичної, неможливо перетворити газ у рідину. Точку О називають потрійною. У цій точці речовина перебуває в трьох агрегатних станах – твердому, рідкому і газоподібному. Прикладом такої точки може бути
Криві ОА, ОВ і ОС визначають так звані фазові переходи, коли нагромаджені в речовині непомітні кількісні зміни переходять у якісні стрибкоподібно. Наприклад, нагріваючи кристал при р = const, можна поступово наблизитись до кривої співіснування ОВ, де речовина стрибкоподібно втрачає типові властивості кристалічного тіла й переходить у рідкий стан (bb’). Аналогічно можна уявити інші фазові переходи: рідина – газ (kk’), кристал – газ (аа’). Фазові переходи можна здійснити за сталої температури, якщо змінювати тиск. Звичайно, в загальному випадку можна змінювати обидва параметри. При цьому зміна окремої властивості чи втрата її не означає якісного перетворення, перетворення в якісно інший стан. Адже зміна якості – це докорінне перетворення тіла. Зігнутий цвях – цвях, намагнічене залізо – залізо, нагрітий кристал – кристал, стиснений газ – газ і т. д. Отже, якщо тілу надавати або відбирати теплоту, то змінюються його окремі властивості, але ці кількісні зміни спричинюють перехід тіла в нову якість лише при перетині кривих співіснування.
Проте фазовий перехід зумовлений не тільки тиском і температурою, а й конкретними умовами експерименту, наприклад домішками сторонніх речовин. Так, сторонні домішки при кристалізації можуть істотно вплинути на форму кристалів. Якщо їх немає, то можна минути кристалізацію і перевести тіло з рідкого в аморфний стан (твердий стан, для якого немає впорядкованості в розміщенні частинок).
Прикладом якісних перетворень можуть бути хімічні реакції, заміна пружної деформації пластичною при певних навантаженнях для певного тіла, перехід ламінарного потоку рідини в турбулентний при великих швидкостях. Якісні зміни зумовлені хімічним складом, внутрішньою будовою тіл, їхньою формою, внутрішньою енергією, а частіше поєднанням усіх цих факторів. Якість виражає відносну стійкість тіла, збереження його основних особливостей. Кількість виражає мінливість властивостей тіла, визначає відношення його до інших тіл. Кількісні зміни – поступові, можуть бути незначними, непомітними, прихованими; зміни якісні – перервні, різкі, явні. Точки кипіння, плавлення, кристалізації та інші, при яких кількісні накопичення приходять до якісних змін, Ф. Енгельс назвав вузловими точками.