Електричний струм у рідинах
1-й семестр
ЕЛЕКТРОМАГНІТНІ ЯВИЩА
2. Електричний струм
Урок 25/31
Тема. Електричний струм у рідинах
Мета уроку: роз’яснити учням фізичну природу електропровідності рідин.
Тип уроку: урок вивчення нового матеріалу.
План уроку
Контроль знань | 5 хв. | 1. Чому метали мають електропровідність? 2. Як пояснити наявність опору у провідників? 3. Поясніть закон Джоуля-Ленца з погляду електронної теорії? 4. Поясніть, чому опір провідників залежить від температури |
Демонстрації | 5 | 1. Порівняння електропровідності води й розчину солі або кислоти. 2. Електроліз розчину мідного купоросу. |
Вивчення нового матеріалу | 25 хв. | 1. Знайомимося з електролітами. 2. Електричний струм в електролітах. 3. Закон Фарадея |
Закріплення вивченого матеріалу | 10 хв. | 1. Контрольні питання. 2. Навчаємося розв’язувати задачі |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Знайомимося з електролітами
Чи проводять рідини електричний струм? Розглянемо дослід. У посудину з дистильованою
У такий же спосіб можна переконатися, що суха кам’яна сіль так само є діелектриком.
А тепер “об’єднаємо” ці два діелектрики: насиплемо у посудину з водою дві-три ложки кам’яної солі. Ми побачимо, що лампочка загориться, причому в міру розчинення солі розжарення лампи збільшується.
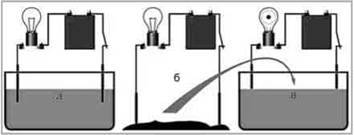
Цей дослід доводить, що підсолена вода є провідником, причому носії заряду з’являються під час розчинення солі у воді.
За допомогою подібних дослідів можна визначити, що практично усі водні розчини солей, кислот і лугів є провідниками електричного струму.
O Електролітами називаються речовини, розчини яких проводять електричний струм.
Чим же обумовлюється провідність електролітів?
2. Електричний струм в електролітах
Молекули солей, кислот і лугів утворені позитивними й негативними іонами, що утримуються силами електростатичного притягування. Наприклад, у молекулах кам’яної солі NaCl позитивно заряджений іон натрію Na+ притягується до негативного іона хлору Cl-. У водяному розчині молекули води послаблюють зв’язок між іонами:
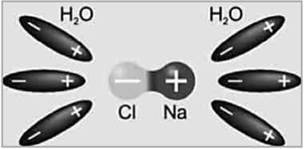
При зіткненнях, обумовлених тепловим рухом, молекула розпадається на позитивні й негативні іони, що стають носіями заряду в електроліті.
Таким чином, носіями заряду в електролітах є іони, тобто електроліти мають іонну провідність.
O Розпад молекул на іони називають електролітичною дисоціацією.
Зі збільшенням температури ступінь дисоціації зростає, а, отже, збільшується концентрація позитивно і негативно заряджених іонів.
У розчині може відбуватися також процес, що називається рекомбінацією.
O Рекомбінація – процес з’єднання іонів у нейтральні молекули.
Між процесами електролітичної дисоціації й рекомбінації іонів за незмінних умов установлюється динамічна рівновага, за якої число молекул, що розпадаються на іони за одиницю часу, дорівнює числу пар іонів, що за цей час з’єднуються в нейтральні молекули.
Іони в електролітах рухаються хаотично доти, поки в рідину не опускаються електроди. Тоді на хаотичний рух іонів накладається їхній упорядкований рух до відповідних електродів, і в рідині виникає електричний струм.
За іонної провідності проходження струму пов’язане з переносом речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
O Процес виділення речовини на електродах при проходженні електричного струму через електроліт називають електролізом. На аноді негативно заряджені іони віддають свої зайві електрони (у хімії цей процес називається окисною реакцією), а на катоді позитивні іони одержують електрони, яких не вистачає (відновна реакція).
3. Закон Фарадея
Кожний іон, що в процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має визначену масу. Але водночас він переносить через електроліт визначений заряд. Тому і маса речовини, що виділилася, і кількість електрики, що пройшла, пропорційні числу іонів, що підходять до даного електроду.
Кількісно закон електролізу був установлений дослідним шляхом Майклом Фарадеєм у першій половині ХІХ сторіччя. Фарадей виявив, що
O маса речовини, яка виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.
M = kq.
Оскільки q = It, де I – сила струму, t – час проходження струму, то m = kІt.
Сталу k називають електрохімічним еквівалентом речовини. Зміст цього коефіцієнта можна з’ясувати з виразу:
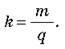
O Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Як бачимо, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для тієї самої речовини в різних сполуках, у яких вона має різну валентність (наприклад, CuCl і CuSO4).
Питання до учнів у ході викладу нового матеріалу
– Що являє собою електричний струм у рідинах?
– Які речовини є електролітами? Наведіть приклади.
– Чи відбувається дисоціація в розчині, у якому немає електричного струму?
– Яка умова необхідна для виникнення спрямованого руху іонів у електроліті?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1). Якісні питання
1. Які речовини є електролітами? Чому електроліт загалом електронейтральний?
2. Що являє собою електричний струм в електролітах?
3. Якими діями супроводжується проходження струму через електроліти?
4. Чому при проходженні струму через розчин електроліту відбувається перенос речовини, а при проходженні через металевий провідник перенос речовини не відбувається?
2). Навчаємося розв’язувати задачі
1. Виразіть електрохімічний еквівалент речовини через масу й заряд іона цієї речовини.
Розв’язок. Маса m речовини, що виділилася на електроді, пов’язана з масою m0 одного іона і числом іонів N, які досягли електрода, співвідношенням m = Nm0. Заряд q, перенесений іонами, виразимо через кількість іонів N і заряд одного іона en, де е – модуль заряду електрона, а n – число зайвих (або тих, що не вистачає) електронів в іона (його валентність). Таким чином, одержуємо q = Nen. Таким чином, електрохімічний еквівалент дорівнює 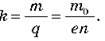
2. За якої сили струму проводився електроліз розчину CuSO4, якщо за 25 хв. на катоді виділилося 2 г міді? (Відповідь: 4 А.)
3. У процесі електролізу з водного розчину срібної солі виділилося 500 мг срібла. Який заряд пройшов через електролітичну ванну? (Відповідь: 450 Кл.)
Що ми дізналися на уроці
– Електролітами називаються речовини, розчини яких проводять електричний струм.
– Розпад молекул на іони називають електролітичною дисоціацією.
– Рекомбінація – процес з’єднання іонів у нейтральні молекули.
– Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом.
– Маса речовини, що виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.
M = kq.
– Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Домашнє завдання
1. Підр.: § 19.
2. Зб.:
Рів1 – № 11.4; 11.5; 11.6; 11.20.
Рів2 – № 11.21; 11.22; 11.23; 11.24.
Рів3 – № 11.37, 11.38; 11.39; 11.40.