ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ
“ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ”
Інтегрований урок з фізики й хімії
Мета. Дати учням уявлення про електроліз як окисно-відновний процес; розвивати вміння спостерігати, аналізувати фізичні й хімічні явища, робити висновки; закріпити поняття “електролітична дисоціація”, “окисно-відновні реакції”, показати єдність законів фізики і хімії.
Тип уроку. Урок вивчення нового матеріалу.
Обладнання. Таблиця “Електроліз солей”, чеканка, позолочені вироби (годинник, ланцюжок), кінофільм
Методичні поради. Відомо, що матеріал, вивчений у процесі самостійної діяльності, засвоюється значно краще, ніж вивчений пасивно (прочитаний або прослуханий). Найефективнішими є такі уроки вивчення нового матеріалу, на яких роль учителя зводиться до організації активного пізнавального процесу, коли учні самі “відкривають” закони та їхні наслідки.
Робота школярів у малих групах
Роботу в групах слід розглядати не як заміну традиційної форми уроку, як доповнення до неї, оскільки завдання, що вирішуються в рамках цих форм, різні.
Плануючи уроки вивчення нового матеріалу, слід спиратися на логічний ланцюжок гіпотетично-дедуктивного методу науки.
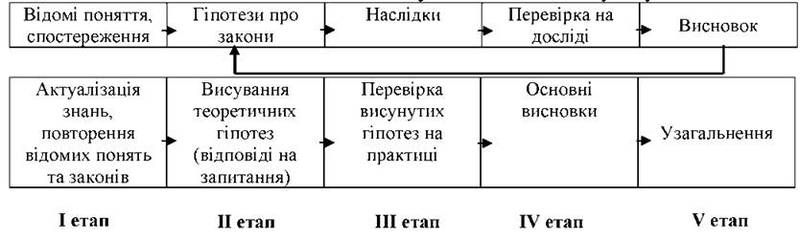
При цьому важливо не лише розкрити етапи побудови теорії тих чи інших явищ, а й визначити їхню роль у цьому процесі.
Слід особливо підкреслити значення узагальнення, яке дає змогу звести одне ціле результати діяльності груп. Іноді доцільно таке узагальнення зі пропонувати учням як домашнє завдання.
Основою до уроків є комплекти карток-завдань, які пропонуються група на І-III етапах (див. таблицю).
Середня чисельність учнів у більшості класів становить 20-25 осіб, том комплект завдань розраховується на 4-5 груп по 4-5 учнів у кожній. Збільшення чисельності групи різко знижує ефективність праці і призводить до пасивності окремих учнів.
Групи комплектуються з урахуванням бажань учнів, учитель лише коригує їхній склад. Важливо простежити, щоб у кожній групі були учні, спроможні виконати завдання.
Хід уроку
Учитель хімії. Усе те, що ми вивчаємо на уроках хімії й фізики, має неабияке значення в житті людини. Чим же корисний електроліз для людині Щоб ви могли дати чітку відповідь, нам сьогодні потрібно з’ясувати суть процесу електролізу, тобто з’ясувати, що відбувається з речовинами під час цього процесу, навчитися записувати рівняння реакції електролізу розплавів розчинів солей.
Щоб знайти відповідь на ці питання, потрібно повторити матеріал тем “Електролітична дисоціація”, який вивчався на попередніх уроках. Працюватимемо групами. Кожна група отримує кілька запитань. На обговорення відводиться 3 хвилини. Доповнення оцінюються додатковими балами. На третє запитання, можливо, вам буде важко відповісти, але будь-яка відповідь буде зарахована.
Учні відповідають на запитання.
Група 1
1. Що таке електричний струм? За яких умов він існує?
2. Які речовини називають електролітами? Навести приклади.
3. Що таке електроліз? Де він використовується?
Група 2
1. Чому лише розчини і розплави проводять електричний струм?
2. Яка вода проводить електричний струм? Чому? Як дисоціює вода?
3. Що таке електроліз? Де він використовується?
Група 3
1. Що таке іони; аніони; катіони?
2. Які речовини називають солями з точки зору електролітичної дисоціації? Навести приклади.
3. Що таке електроліз? Де він використовується?
Група 4
1. Які реакції називають окисно-відновними?
2. Що називають окисником; відновником?
3. Що таке електроліз? Де він використовується?
Група 5
1. Що ви знаєте про ряд електрохімічних напруг металів? Чи здатні ці метали окислюватися?
2. Що таке катод; анод?
3. Що таке електроліз? Де він використовується?
Ви бачите, що на останнє запитання відповіді різні. Отже, нашим завданням на цьому уроці є знайти істину.
Хімія і фізика – прикладні науки, тому звернімося до дослідів.
Учитель фізики. Зберемо електричне коло за схемою (мал. 1), перевіримо електропровідність солі купром (II) хлориду (CuCl2). Для цього мідні електроди зануримо в сіль і замкнемо коло. Що показує амперметр?
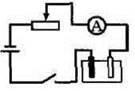
Мал. 1.
– Сила струму дорівнює нулю.
– Як ви вважаєте, чому?
– Немає струму, оскільки немає носіїв зарядів.
– Витремо насухо мідні електроди і зануримо їх у дистильовану воду. Спостерігаємо за показами амперметра.
– Сила струму дорівнює нулю, оскільки немає носіїв зарядів.
– Всиплемо сіль купром (II) хлорид у воду, розмішаємо скляною паличкою, замкнемо коло і спостерігатимемо за показами амперметра.
– Покази є.
Учитель хімії. Що відбувається з розчином солі купром (II) хлориду, коли крізь нього пропускати постійний електричний струм?
Обговорюємо це питання і на дошці записуємо алгоритм процесу, який відбувається у розчині солей неактивних металів.
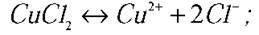
Катод: 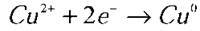 (відновлюється);
(відновлюється);
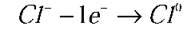
Анод: 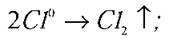 (окислюється);
(окислюється);
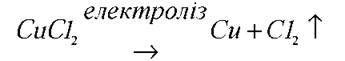
Який же процес спостерігається під час проходження постійного електричного струму крізь розчин солі?
– Окисно-відновний.
– Із чим пов’язаний цей процес?
– З віддачею або приєднанням електронів іонами.
Електроліз – це окисно-відновні реакції, які відбуваються на електродах або в розплаві електроліту під час пропускання постійного електричного струму, внаслідок чого на електродах виділяється речовина.
Такі процеси відбуваються і в розплаві солі або лугу. Детальніше ми розглянемо цей процес на наступних уроках та факультативному занятті.
Учитель фізики. Розімкнемо коло. Висушимо електроди і розглянемо їх. Що ми побачимо?
– Катод укрився тонким шаром міді.
– Як визначити масу чистої міді, яка виділилася на катоді?
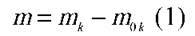
– А ще як?
– Масу одного іона Cu помножити на їхню кількість:
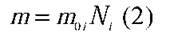
– А як знайти масу одного іона Cu?
– Потрібно молярну масу Cu поділити на число Авогадро:
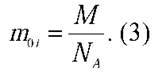
І знайдений вираз підставити у формулу (2).
– Як же знайти кількість іонів Cu в розчині під час проходження крізь нього електричного струму?
– Потрібно загальний заряд іонів поділити на заряд одного іона:
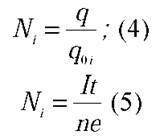
Знайдені вирази (3) і (5) підставимо у формулу (2).
– Ми отримали закон електролізу:
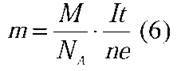
– Цей закон відкрив 1837 р. англійський фізик Майкл Фарадей. Вам знайоме це ім’я? Що ви можете про нього розповісти?
(Невелике доповнення дає учень, який підготував це повідомлення.)
– Добуток NA на e називається сталою Фарадея і позначається літерою F:
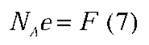
Величина 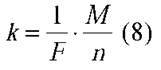 називається електрохімічним еквівалентом. Тоді закон електролізу можна записати у такому вигляді:
називається електрохімічним еквівалентом. Тоді закон електролізу можна записати у такому вигляді:
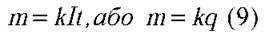
Маса речовини, що виділяється на електроді під час електролізу, прямо пропорційна до електричного заряду, який пройшов крізь електроліт.
– А зараз визначте масу у вашому досліді.
(Учні виконують завдання.)
Учитель хімії. Тепер ви вже можете відповісти на запитання: яке значення має гідроліз? Для чого він використовується?
(Пояснення дають учні, які готували доповіді. Перегляд кіноплівки “Використання електролізу”.)
Учитель фізики. Повернімося до нашого досліду. Нам уже відомо, скільки виділилося чистої міді. А як визначити заряд, який пройшов крізь електроліт?
– Потрібно масу міді поділити на
– У збірнику задач знайдіть таблицю значень електрохімічних еквівалентів і визначте k для міді, (k = 0,33-10-6 кг/Кл.)
– Правильно. А як це розуміти?
– Це маса речовини, яка виділилася на катоді під час проходження заряду в 1 Кл крізь електроліт.
– Визначимо заряд, що пройшов через розчин, у нашій роботі. (Учні виконують завдання.)
Учитель хімії. Розв’яжемо таку задачу: під час електролізу крізь розчин ферум (III) хлорид (FeCl3) проходить заряд, який дорівнює 5-104 Кл. Скільки при цьому виділилося заліза і хлору? На якому електроді виділився хлор, а на якому – залізо?
Розв’язання 1
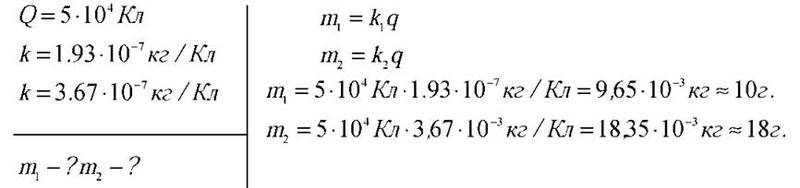
Розв’язання 2
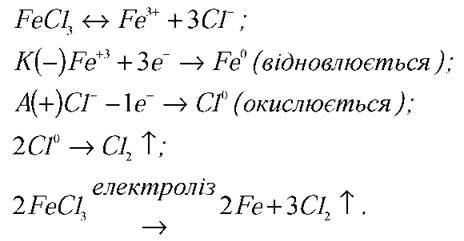
Підбиваючи підсумок уроку, вчителі підкреслюють те нове, що засвоїли учні з точки зору фізики та хімії.