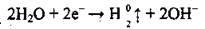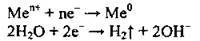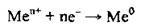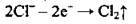Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.13. Електроліз
6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей)
Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть відбуватися такі процеси:
– на катоді: 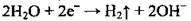 (відновлюється Гідроген з утворенням
(відновлюється Гідроген з утворенням
– на аноді: 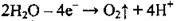 (окислюється Оксиген з утворенням кисню).
(окислюється Оксиген з утворенням кисню).
Чи утворюються продукти окиснення – відновлення води, залежить від природи розчиненої речовини і відповідно хімічного складу розчину (катіонів, аніонів)1.
І. Катодні (відновні) процеси
На катоді може відбуватися відновлення катіонів металічного елемента, іонів Гідрогену (у випадку електролізу розчинів кислот або молекул води). Іони металічних елементів відновлюються тим легше, чим менший їхній електрохімічний потенціал:
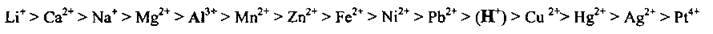
Залежно від активності металічного елемента, від якого походить
Li+, Са2+, Na+, Mg2+, Al3+ | Мn2+, Zn2+, Fe2+, Ni2+, Pb2+ | Н+ | Cu2+, Hg2+, Ag+, Pt4+ |
Ці катіони, які утворені найактивнішими металами, на катоді не відновлюються. Відновлюється вода з утворенням водню:
| Ці катіони відновлюються одночасно з молекулами води, утворюючи відповідні метали і водень:
| Ці катіони відновлюються легко і практично повністю з утворенням відповідних металів:
|
II. Анодні (окисні) процеси
Окисна здатність аніонів залежить від їхнього складу. За здатністю окислюватися їх також можна розмістити в ряд:
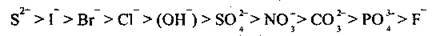
На аноді може відбуватися окиснення аніонів лише безоксигенових кислот (за винятком флуорид-іона F-):
S2-, I-, Вr-, Сl- | ОН- | SO42-, NO3-, СO32-, РО43-, F- |
Аніони безоксигенових кислот (за винятком F-) легко окислюються: | Аніони оксигеновмісних кислот не окислюються, замість них окислюється вода (виділяється кисень):
|
Розгляньмо приклади електролізу водних розчинів солей.
Приклад 4. Електроліз розчину CuSO4:
1. Записуємо рівняння електролітичної дисоціації купрум(ІІ) сульфату:
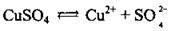
2. Біля катода, крім молекул води, накопичуються іони Сu2+, які й відновлюються:
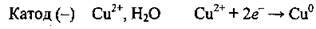
3. Біля анода, крім молекул води, накопичуються сульфат-іони SO42-, які, однак, не окислюються. Окислюються молекули води:
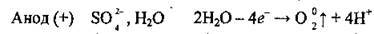
Таким чином утворюється сульфатна кислота.
Далі аналогічно до дій 4-5 прикладу 1 проводять електронний баланс, сумують електронні рівняйю і отримують молекулярне рівняння електролізу:
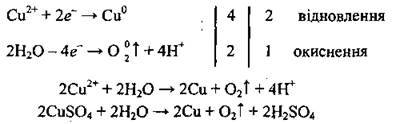
Приклад 5. Електроліз водного розчину КСl:

Приклад 6. Електроліз водного розчину Na2SO4:
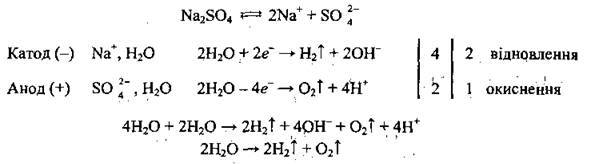
Приклад 7. Електроліз водного розчину натрій сульфіду
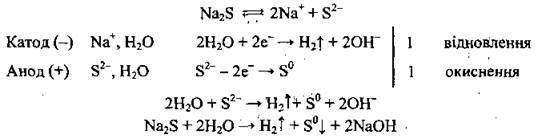
Зазначимо, що в розглянутих вище прикладах описано електроліз з використанням інертних електродів, їх виготовляють з графіту, платини, золота, які не беруть участі в електролізі. Електроди, виготовлені з активніших металів, називають розчинними, тому що вони під час електролізу окислюються.
Приклад 8. Електроліз розчину CuSO4 з використанням мідного анода.
Процеси, які відбуваються, подібні до тих, що описані в прикладі 4:
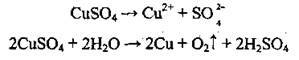
Але якщо використовують не інертний (графітовий) анод, а розчинний (у нашому випадку – мідний), відбувається його розчинення – окиснення міді:
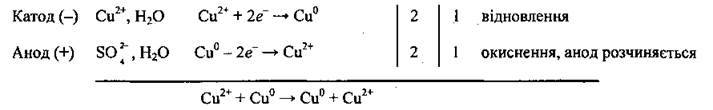
Кількість міді, яка відновлюється на катоді й окислюється при розчиненні анода, однакова. Тому концентрація йонів Сu2+ у розчині залишається незмінною. На катоді виділяється дуже чиста мідь, а домішки, які є в металі анода, залишаються у розчині або (частіше) випадають в осад (шлам). Такий процес називають електролітичним рафінуванням і використовують для очистки міді, нікеля, срібла, свинцю та інших металів від домішок.
_________________________________________________________
1 У загальному на хід електролізу і вихід кінцевих продуктів також впливає природа розчинника, концентрація електроліту, матеріал, з якого виготовлені електроди (див. Приклад 8), електродний потенціал, температура, деякі інші умови.