ЕЛЕКТРОННА БУДОВА АТОМА
Хімія – універсальний довідник
БУДОВА АТОМА
ЕЛЕКТРОННА БУДОВА АТОМА
Хімічні властивості визначаються електронною будовою атома.
Описати електронну будова атома – це означає, насамперед, зазначити розподіл електронної густини біля ядра, тобто визначити ділянку простору, де можуть знаходитися електрони даного атома.
Але для повного опису електронної будови атома цього недостатньо. Найважливішою характеристикою руху електрона на даній орбіталі є енергія притягання його ядром або енергія зв’язку його з ядром.
В
Заряд ядра атома Гелію (+2) більший, ніж атома Гідрогену (+1). Виходить, і енергія притягання більша; оскільки два електрони, наявні в атомі Гелію, відштовхуються один від одного, їх енергія зв’язку з ядром менша подвоєної енергії зв’язку електрона в атомі Гідрогену і складає -2400 кДж/моль.
Посилення зв’язку з ядром
Наступний за складністю будови – атом Літію, що має три електрони. Два з них займають таку ж орбіталь, як і електрони в атомах Н і Не (тільки ця орбіталь ще більше стиснута біля ядра). А третього електрона тут бути не може. Нагадаємо – на одній орбіталі може бути не більш двох електронів, тому третій електрон має знаходитися на іншій орбіталі. Ця орбіталь також є сферою, тільки значно більшого радіуса.
Енергія зв’язку з ядром третього електрона (надалі будемо називати просто “енергія електрона”) набагато менша (за модулем), ніж перших двох, що знаходяться до ядра ближче: значення енергій складають -520 і -7000 кДж/моль відповідно. У даному випадку кажуть, що електрон знаходиться на іншому енергетичному рівні. Позначимо найближчий до ядра рівень № 1, тоді третій електрон в атомі Літію знаходиться на рівні № 2, або просто – на 2-ому рівні.
Орбіталі, що мають сферичну форму, називаються s-орбіталями. В атомі Гідрогену електрон знаходиться на 1s-орбіталі (1 – номер рівня, s – назва орбіталі). В атомі Не обидва електрони знаходяться на такій же 1s-орбіталі. В атомі Lі два електрони займають і один електрон – 2s-орбіталь.
Тепер легко описати електронну будову атома елемента, наступного за Літієм, – Берилію. У нього є чотири електрони. Два з них займають 1s-орбіталь і два – 2s-орбіталь. Порівняно з атомом Літію атом Берилію менший, оскільки має великий заряд ядра, що сильніше стискує орбіталі, ніж у випадку з Літієм.
Таким чином, в атомі Берилію 1s – і 2s-орбіталі виявляються повністю зайнятими, тому в атомі наступного елемента – Бору додатковий п’ятий електрон повинен зайняти нову орбіталь.
На відміну від стану електрона на першому енергетичному рівні, на якому є лише одна орбіталь, а саме 1s, на другому рівні, більш віддаленому від ядра, рух електронів може описуватися двома різними способами. На другому енергетичному рівні є два види орбіталей. З одним із них ви вже знайомі – це сферична s-орбіталь. Інший вид орбіталей – р-орбіталі, що мають форму об’ємної вісімки (або гантелі). На кожному енергетичному рівні (крім першого) є по три р-орбіталі, вони взаємно перпендикулярно орієнтовані у просторі вздовж осей х, у i z відповідно позначаються рх, ру, рz.
На кожній р-орбіталі (як і на s – і будь-яких інших) може знаходитися не більш двох електронів. Усього, таким чином, на 2-ому енергетичному рівні може бути не більше восьми електронів (два електрони на 2s-орбіталі і по два електрони на кожній із трьох 2р-орбіталей), на відміну від першого рівня, де є тільки одна орбіталь.
Р-Орбіталі послідовно заповнюються в атомах наступних за Берилієм елементів: В, С… аж до Неону Nе. Розподіл електронів в атомі Неону (10 електронів) можна записати формулою:
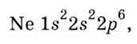
Яка означає, що на 1-ому рівні на 1s-орбіталі знаходяться два електрони, на 2-ому рівні на 2s-орбіталі – два електрони і на 2р-орбіталях – шість електронів.
Поданий запис електронної будови називається електронною формулою атома.
В атома наступного після Неону елемента – Натрію – додається ще один електрон. Але усі орбіталі перших двох рівнів заповнені, і цей електрон займає s-орбіталь 3-го рівня – Зs-орбіталь. Вона знаходиться ще далі від ядра, енергія зв’язку цього електрона з ядром ще менша, ніж в електронів на 1s – і 2s-орбіталях.