Електропровідність електролітів. Закони Фарадея
ФІЗИКА
Частина 3 ЕЛЕКТРИКА І МАГНЕТИЗМ
Розділ 8 ЕЛЕКТРИКА
8.10. Електропровідність електролітів. Закони Фарадея
Електроліти – розчини солей, кислот, лугів у рідинах – є добрими провідниками електричного струму. Струм у електролітах супроводжується електролізом – виділенням на електродах, занурених у розчин, складових частин електроліту. На відміну від металів, яким властива електронна провідність, струм в електролітах зумовлений напрямленим рухом іонів. Йони виникають унаслідок взаємодії молекул розчиненої речовини
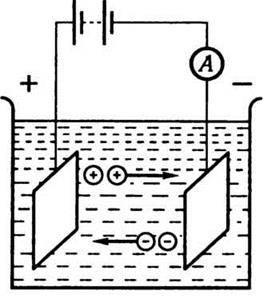
Рис. 8.6
Якщо в електроліт занурити два електроди і створити між ними різницю потенціалів, то виникне впорядкований рух іонів або сольватів (сольват складається з іона та сольватної оболонки, що містить кілька шарів молекул розчинника).
Нехай в одиниці об’єму міститься n+ позитивних і n – негативних носіїв електричного заряду. Абсолютне
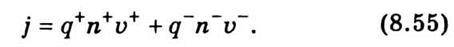
Із закону збереження електричного заряду (умова електронейтральності розчину електроліту) випливає рівність сумарних позитивних та негативних зарядів:
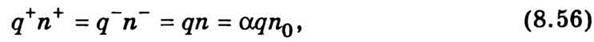
Де n – кількість дисоційованих молекул для одно-одновалентних солей; n0 – концентрація молекул розчиненої речовини; α – коефіцієнт дисоціації, що дорівнює відношенню концентрації іонів одного знака до концентрації молекул розчиненої речовини. Тоді густина струму

Швидкість упорядкованого руху іонів (сольватів) можна знайти з таких міркувань. На окремий іон діє сила з боку електричного поля 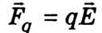 та сила тертя Стокса
та сила тертя Стокса 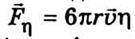 (r – радіус іона; и – швидкість руху іона;
(r – радіус іона; и – швидкість руху іона; 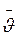 – коефіцієнт в’язкості рідини).
– коефіцієнт в’язкості рідини).
Іон рухатиметься рівномірно, якщо сила 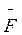 η дорівнює силі
η дорівнює силі 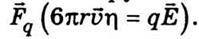 Звідси дістанемо вираз для швидкості іона
Звідси дістанемо вираз для швидкості іона

А для його рухливості

Із формул (8.57) та (8.59) випливає, що для електролітів закон Ома має такий вигляд:
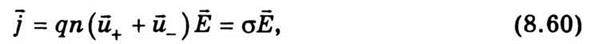
Де σ – електропровідність електроліту, що дорівнює

Електропровідність електролітів значно менша, ніж електропровідність металів. З підвищенням температури електропровідність електролітів швидко зростає, що зумовлено збільшенням ступеня дисоціації розчину та зменшенням в’язкості електроліту.
Основні закони електролізу експериментально встановив М. Фарадей 1834 р.
Перший закон Фарадея: маса речовини, яка виділяється на електроді, прямо пропорційна кількості електрики q, що пройшла через електроліт:

Де І – сила струму; t – час проходження струму. Коефіцієнт пропорційності k, який чисельно дорівнює масі речовини, що виділяється на електроді при проходженні через електроліт одиниці кількості електрики, називається електрохімічним еквівалентом речовини.
Другий закон Фарадея: електрохімічні еквіваленти елементів прямо пропорційні їхнім хімічним еквівалентам. Хімічним еквівалентом елемента називають відношення його атомної маси А до валентності Z. Тому

Згідно з другим законом Фарадея коефіцієнт с є універсальною сталою для всіх елементів. Звичайно замість сталої с користуються оберненою до неї величиною F = 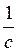 , яку називають числом Фарадея.
, яку називають числом Фарадея.
Отже,

Підставимо цей вираз у (8.62) і дістанемо формулу, що об’єднує обидва закони Фарадея:
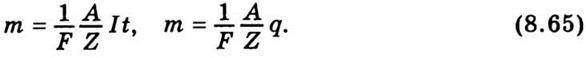
Звідси неважко з’ясувати фізичний зміст сталої Фарадея. Справді, якщо при електролізі виділяється m / А = 1 / Z молів речовини, то заряд д, що пройшов через електроліт, чисельно дорівнює F. Дослід показує, що F = 96485,309 Кл/моль.
Проходження струму через електроліти нерозривно пов’язане з переміщенням речовини. Звідси випливає, що в електролітах, на відміну від металевих провідників (провідників першого роду), носіями струму є не вільні електрони, а іони – заряджені частинки речовини. Йони – це атоми або групи атомів, які мають надлишок або недостачу електронів порівняно з нейтральними атомами й молекулами.
Із законів Фарадея випливає, що будь-який електричний заряд складається з цілого числа елементарних зарядів – “атомів електрики”. На це вперше звернув увагу Г. Гельмгольц 1881 р. у промові, присвяченій пам’яті Фарадея, де він підкреслив, що, приймаючи існування атомів хімічних елементів, не можна уникнути подальшого висновку про атомність електрики. Справді, для виділення на електроді одного моля одновалентної речовини потрібно, щоб через електроліт пройшла кількість електрики, яка дорівнює числу Фарадея F. Якщо речовина має валентність Z, то для виділення на електроді одного моля потрібна кількість електрики, що дорівнює ZF. Оскільки при цьому переноситься те саме число NА частинок (іонів) речовини (число Авогадро), то на окрему частинку Z-валентної речовини припадає заряд

А у випадку одновалентної речовини

Звідси можна зробити два висновки: 1) заряди Z-валентних іонів різні, але середнє значення їх дорівнює 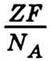 (подібно до того, як молекули газу мають різну кінетичну енергію поступального руху, а середнє значення її дорівнює
(подібно до того, як молекули газу мають різну кінетичну енергію поступального руху, а середнє значення її дорівнює 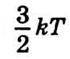 ; 2) кожний iон має певний заряд
; 2) кожний iон має певний заряд 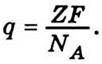 Причому заряди іонів можуть відрізнятися лише на значення, кратні елементарному заряду, що дорівнює заряду одновалентного iона
Причому заряди іонів можуть відрізнятися лише на значення, кратні елементарному заряду, що дорівнює заряду одновалентного iона 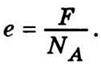 Другий висновок еквівалентний припущенню про атомну (“зернисту”) будову всіх електричних зарядів. Досліди підтвердили справедливість такого висновку.
Другий висновок еквівалентний припущенню про атомну (“зернисту”) будову всіх електричних зарядів. Досліди підтвердили справедливість такого висновку.