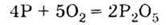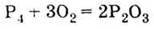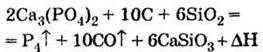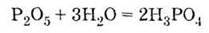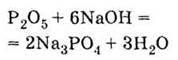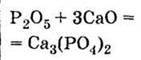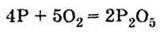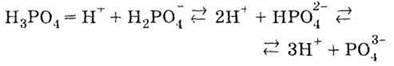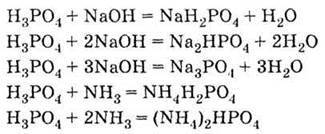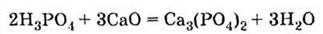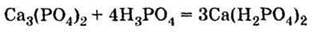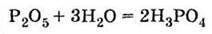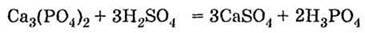ФОСФОР I ЙОГО СПОЛУКИ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
ФОСФОР I ЙОГО СПОЛУКИ
Радіус атома Фосфору майже у два рази більший, ніж Нітрогену. Це зумовлює суттєві відмінності у їхніх властивостях.
Різниця в розмірах атомів позначається уже в будові простих речовин. Молекули азоту, утворені маленькими атомами, двохатомні. Збільшення розміру атомів веде до менш ефективного перекривання їх атомних орбіталей і водночас створює умови для одночасного перекривання орбіталей одразу багатьох атомів, тобто до утворення багатоатомних
Фосфор у промисловості одержують відновленням природних фосфатів коксом за температур, близьких до 1500 °С. Під час охолодження газоподібних продуктів утворюються одразу, минаючи стадію рідини, кристали так званого білого фосфору, кристалічна гратка якого утворена молекулами Р4.
Ця алотропна модифікація фосфору хімічно дуже активна. Уже при кімнатній температурі білий фосфор окислюється киснем повітря:
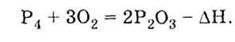
Таблиця
Фосфор і його сполуки
Фосфор | Сполуки фосфору. | |
Оксид фосфору (V) | Ортофосфатна кислота | |
1. За звичайних умов може існувати у вигляді двох алотропних модифікацій: червоний і білий фосфор 2. Горить у кисні (проявляє відновні властивості):
Білий фосфор окислюється на повітрі при кімнатній температурі:
Одержання Відновленням природного фосфату кальцію за допомогою коксу (вуглець) і кварцового піску SiO2
| 1. За звичайних умов дуже гігроскопічна тверда речовина білого кольору 2. Проявляє властивості кислотних оксидів, взаємодіючи з водою:
З лугами:
З основними оксидами:
Одержання Спалюванням фосфору в надлишку повітря:
| 1. За звичайних умов безбарвна тверда речовина, необмежено розчинна у воді 2. Слабка трьохосновна кислота:
3. Взаємодіє з лугами, основами і амфотерними гідроксидами, а також аміаком:
4. Взаємодіє з основними оксидами:
5. Взаємодіє з фосфатом кальцію, утворюючи дигідрофосфат (подвійний суперфосфат):
Одержання у промисловості 1) за реакцією оксиду фосфору (V) з водою:
2) за реакцією фосфату кальцію з сульфатною кислотою при нагріванні:
|
Своєрідність даної реакції полягає в тому, що практично вся її енергія виділяється у вигляді світла, тому суміші, які мають вміст білого фосфору, світяться на повітрі. Це явище використовувалося раніше, наприклад, у процесі виготовлення циферблатів і стрілок годинників та інших приладів. Звідси і назва фосфору: “фосфорос” (від грец. – той, що світиться). На здатності білого фосфору загорятися при слабкому нагріванні, у тому числі від тертя, було засноване виробництво сірників. Але саме тому вони були дуже небезпечні у користуванні і ставали причиною багатьох нещасних випадків. До того ж висока хімічна активність білого фосфору зумовлює його отруйність.
Друга алотропна модифікація фосфору – червоний фосфор, який має атомну кристалічну гратку, значно менше реакційно здатний і тому неотруйний. Одержаний у результаті реакції відновлення фосфату білий фосфор перетворюють у червоний нагріванням без доступу повітря.
Червоний фосфор використовується в сучасному виробництві сірників (він входить до складу намазки на коробці). Але основна його кількість витрачається на одержання ортофосфатної кислоти за реакцією:
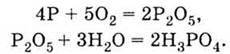
Безводна ортофосфатна кислота Н3РO4, на відміну від описаних у попередніх розділах кислот – газоподібної НСl і рідких Н2SO4 і НNO3, – тверда безбарвна речовина, яка змішується з водою (як Н2SO4 і НNO3) практично в усіх співвідношеннях.
На відміну від розглянутих нами раніше кислот – це відносно слабка кислота.
Ортофосфатна кислота трьохосновна і тому дисоціює ступінчасто:
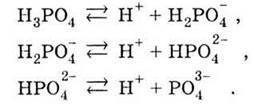
При цьому на кожному наступному щаблі дисоціація відбувається все меншою мірою (у тисячі разів). Наприклад, в 1 М розчині Н3РO4 концентрація іонів Н2РO4- дорівнює 8 – 10-2 моль/л, НРO4 – 7 – 10-5 моль/л і РO43- – 1 – 10-8 моль/л.
Таким чином, при дії сильних кислот на фосфати – солі слабкої кислоти – ця кислота і повинна утворюватися.
Другим промисловим способом одержання ортофосфатної кислоти є обробка природних фосфатів сульфатною кислотою:
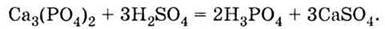
Хімічні властивості фосфору і його сполук узагальнені в таблиці, яка наведена вище.