Гібридизація атомів Карбону і геометрія органічних сполук – ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОРГАНІЧНА ХІМІЯ
ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОРГАНІЧНИХ СПОЛУК
Гібридизація атомів Карбону і геометрія органічних сполук
В молекулах насичених вуглеводнів існує два типи зв’язків: С-С – ковалентний неполярний і С-Н – ковалентний слабополярний. У всіх органічних сполуках, атоми Карбону утворюють по чотири хімічні зв’язки. Валентність атома Карбону має обумовлюватися будовою його електронної оболонки. У звичайному (основному стані)
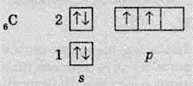
Але для утворення чотирьох зв’язків на зовнішньому рівні має бути чотири неспарені електрони. Для цього атом Карбону поглинає невелику кількість енергії і переходить у збуджений стан, в якому будова його електронної оболонки виявляється наступною:
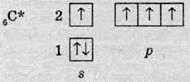
Під час переходу одного електрона на р-орбіталь орбіталі зовнішнього рівня атома карбону також змінюються: одна s-орбіталь та три р-орбіталі утворюють чотири однакові за енергією
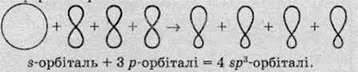
Ці орбіталі називають гібридизованими, а про стан самого атома Карбону говорять, що він перебуває у стані sр3-гібридизації. Оскільки нові орбіталі однакові за енергією, вони мають однаково відштовхуватися одна від одної і тому, на відміну від звичайних р-орбіталей, які розташовані по взаємноперпендикулярних вісях, sр3-гібридизовані орбіталі у просторі розташовані таким чином, що вони спрямовані до вершин тетраедра (правильної трикутної піраміди):

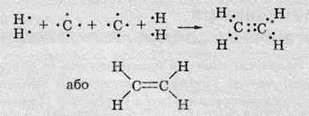
При утворенні хімічних зв’язків атоми Карбону утворюють спільні електронні пари з атомами Гідрогену:
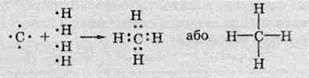
Оскільки спільні електроні пари можуть утворюватися тільки при перекриванні орбіталей, то хімічні зв’язки утворюються в тих самих напрямках, в яких спрямовані гібридизовані орбіталі атома Карбону. Отже, найпростіший алкан – метан – має форму тетраедра: атоми Гідрогену розташовані у його вершинах, а атом Карбону – в його центрі:

Складніші алкани мають схожу будову – це комбінація декількох тетраедрів. Завдяки такій особливості утворення зв’язків в алканах карбоновий ланцюг не утворює лінію, а є зигзагоподібним, причому кут між хімічними зв’язками становить приблизно 109,5 °. В молекулах алканів карбоновий кістяк може по-різному розташовуватися в просторі завдяки вільному обертанню атомів Карбону навколо одинарних зв’язків. Наприклад, карбоновий ланцюг пентану С5Н12 може виглядати так:
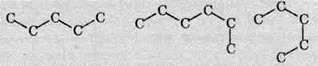
Але всі ці карбонові кістяки відповідають одній речовині з нерозгалуженим ланцюгом:
СН3-СН2-СН2-СН2-CH3.
В молекулах ненасичених вуглеводнів атоми Карбону також чотиривалентні, але хімічні зв’язки вони утворюють не чотирма іншими атомами, а з меншою кількістю. Тому атоми Карбону також мають бути в певному стані гібридизації.
В молекулі етилену атоми Карбону з’єднуються з трьома атомами: два атоми Гідрогену і один атом Карбону. Для утворення такого числа зв’язків атом Карбону перебуває в стані sр2-гібридизації:
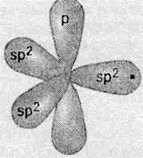
У такому стані в атома Карбону є три sр2-гібридизовані орбіталі, що розташовані в одній площині під кутом 120° одна до одної. А одна р-орбіталь, що не бере участі в гібридизації, розташована перпендикулярно до площини гібридизованих орбіталей.
При утворенні хімічних зв’язків такий атом Карбону за участю гібридизованих орбіталей утворює по одному зв’язку (одній спільній електронній парі), з двома атомами Гідрогену і з іншим атомом Карбону. А р-орбіталі двох сусідніх атомів Карбону утворюють додатковий зв’язок:

Таким чином між двома атомами Карбону утворюються дві спільні електронні пари:
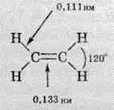
Завдяки такому розташуванню орбіталей молекула етилену є плоскою: всі атоми розташовані в одній площині, і всі валентні кути в ній по 120 °:
На відміну від етилену, в ацетилені атоми Карбону перебувають у стані 8р-гібридизації. В такому стані в атома є тільки дві гібридизовані орбіталі, що розташовані на одній лінії, тобто під кутом 180 °:
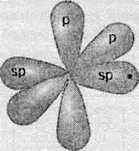
А дві р-орбіталі, що не беруть участі в гібридизації, розташовані взаємно перпендикулярно до гібридизованих орбіталей. При утворенні хімічних зв’язків в ацетилені гібридизовані орбіталі утворюють зв’язки з одним атомом Гідрогену й одним атомом Карбону. При цьому між атомами Карбону утворюється ще два додаткові зв’язки за участю негібридизованих р-орбіталей:
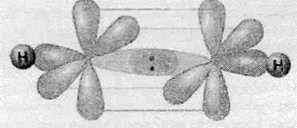
Таким чином між атомами Карбону утворюється три спільні електронні пари, що відповідає потрійному зв’язку:
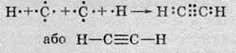
Зверніть увагу, що молекула ацетилену є лінійною: всі атоми розташовані на одній прямій. І зі збільшенням кратності зв’язку зменшується його довжина: якщо в алканах довжина зв’язку С-С становить 0,154 нм, в алкенах зв’язок С=С має довжину 0,133 нм, то в ацетилені потрійний зв’язок вже 0,121 нм.