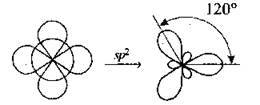Гібридизація електронних орбіталей
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.4. Гібридизація електронних орбіталей
Під час утворення молекул з ковалентним полярним зв’язком у деяких атомів відбувається характерне явище, яке називають гібридизацією електронних орбіталей – перетворення електронних орбіталей різного виду (s, р)1 на однакові за формою та енергією гібридні орбіталі.
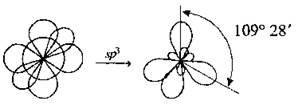
Sp3-гібридизація – змішування одної sта трьох p-орбіталей |
| Утворюється чотири гібридні орбіталі, які спрямовані в просторі до вершин тетраедра* |
Sp2-гібридизація – змішування одної sта двох p-орбіталей |
| Утворюється три гібридні орбіталі, які розміщуються в одній площині під кутом 120°. Одна негібридизована р-орбіталь розміщується перпендикулярно до цієї площини** |
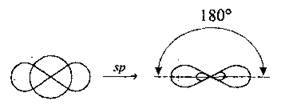
Sp-гібридизація – змішування одної sта одної р-орбіталі |
| Утворюються дві гібридні орбіталі, які розміщуються під кутом 180° по одній лінії. Дві негібридизовані р-орбіталі |
* Залежно від того, скільки гібридизованих орбіталей бере участь у зв’язку, форма молекули може дещо відрізнятись від правильної тетраедричної форми. Так, валентний кут зв’язків Н-О-Н у молекулі води становить 104,5° (залишається дві неподілені пари електронів), а зв’язку H-N-H в молекулі аміаку – 107,3° (залишається одна неподілена пара електронів). У результаті такої взаємодії електронних хмар зміщується (відносно центру молекули) і центр Негативного електричного заряду. Таким чином полярність молекули (крім електронегативності елементів, що утворюють зв’язок) залежить і від наявності неподілених електронних пар.
** Негібридизовані p-орбіталі на рисунку не вказані.
У стані збудження перебуває атом Карбону в органічних сполуках (sp, sp2 і sp3-гібридизація), атом Оксигену – під час утворення молекули води (sp3-гібридизація) та інших молекул, Нітрогену – під час утворення молекули аміаку (sр3-гібридизація), Берилію – під час утворення молекули берилій флуориду (sр-гібридизація), Бору – під час утворення молекули бор флуориду (sp2-гібридизація) тощо.
Стан збудження атома, який передує гібридизації, потребує затрат енергії, які компенсуються повнішим перекриванням електронних хмар і утворенням міцнішого зв’язку. Отже, у результаті загальна енергія системи зменшується.
Кількість утворених орбіталей відповідає кількості орбіталей, які перетворювались (змішувались). У змішуванні може брати участь будь-яка кількість електронів.
Згідно з теорією відштовхування електронних пар, хмари електронів зовнішньої оболонки атома відштовхуються одна від одної та розміщуються так, щоби зменшити це відштовхування. Отже, кути електронних орбіталей (і звичайних, і гібридизованих) і відповідно геометрія молекул – це результат взаємодії електростатичних сил.
Якщо між двома атомами утворюється лише одна спільна ковалентна пара, то такий ковалентний зв’язок називають одинарним (простіш). Одинарні зв’язки завжди є сигма-зв’язками.
__________________________________________________________
1 Гібридизація характерна і для d-елементів (у загальноосвітній школі не розглядають). Найважливішою є sp3d2-гібридизація, коли шість рівноцінних гібридизованих орбіталей спрямовані до вершин октаедра.
 class=""/>
class=""/>