Гідроген – ГІДРОГЕН. ВОДЕНЬ. ВОДА
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ГІДРОГЕН. ВОДЕНЬ. ВОДА
Гідроген
Характеристика хімічного елемента
Гідроген – 1-й елемент Періодичної системи (заряд ядра 1), хімічний знак – Н, відносна атомна маса 1,008 (округлено 1). Валентність Гідрогену у сполуках дорівнює одиниці, найпоширеніший ступінь окиснення +1. Молекула водню Н2, молекулярна маса 2,016 (округлено 2). Молярна маса 2 г/моль.
Поширеність Гідрогену
Якщо Оксиген є найпоширенішим елементом у земній
Імовірно, колись Гідроген входив і в атмосферу Землі. Але через свою легкість він здатний покидати атмосферу, тому частка Гідрогену в повітрі надзвичайно мала. У зв’язаному вигляді Гідроген становить 0,76% маси Землі. Найважливішою сполукою Гідрогену, що трапляється у природі, є вода.
Фізичні властивості
Водень
Неважко підрахувати густину водню: 1 моль за звичайних умов займає 22,4 л, а молярна маса водню дорівнює 2 г. Отже, густина в перерахунку на 1л складе 22 г/22,4 л = 0,09 г/л. Густина повітря помітно вища – 1,305 г/л, тому наповнені воднем предмети зазнають виштовхуючої сили атмосфери.
Водень стає рідким за дуже низьких температур (-253 °С), а твердий водень добути ще важче (температура плавлення твердого водню -259 °С).
Ізотопи Гідрогену
Атом Гідрогену – найпростіший з усіх атомів. Його ядро складається з єдиного протона. Цей (найпоширеніший) ізотоп Гідрогену називають також протієм, щоб відрізнити від дейтерію – іншого ізотопу Гідрогену, у ядрі якого міститься 1 протон і 1 нейтрон. Дейтерій перебуває у природі в дуже невеликій кількості. Проте його навчилися виділяти для потреб ядерної енергетики. Дейтерій – один з небагатьох ізотопів у хімії, який має свій власний символ D. Найвідомішою хімічною сполукою, до якої входить дейтерій, є “важка вода” D2О.
У ядерних реакціях утворюється ще один ізотоп Гідрогену – тритій, у ядрі якого 1 протон і 2 нейтрони. Тритій (хімічний символ Т). радіоактивний і в природі не трапляється.
Таким чином, найбільш відомі три ізотопи Гідрогену: 11Н (або просто Н), 12H (або D), 13Н (або Т). Останнім часом також добуті важчі ізотопи Гідрогену з масою від 4 до 8.
Електронна будова і положення Гідрогену в Періодичній системі
Оскільки в ядрі будь-якого ізотопу Гідрогену завжди тільки один протон, то електронна оболонка включає тільки один електрон, що займає нижній електронний рівень 1s. Таким чином, будь-який ізотоп Гідрогену має тільки одну – і до того ж валентну – оболонку 1s1.
Електронний рівень 1s вміщає не більше 2-х електронів, і атому Гідрогену досить приєднати або втратити один електрон, щоб досягти стійкої електронної конфігурації:
Н – 1ē → Н+ – позитивний іон Гідрогену (в електронній оболонці відсутні електрони)
Н + 1ē → H – – негативний іон Гідрогену (1s2)
Перше рівняння свідчить про споріднений зв’язок Гідрогену з елементами І групи – лужними металами, які охоче віддають єдиний зовнішній електрон і утворюють позитивні іони Li+, Na+, К+ тощо. Друге рівняння свідчить про близькість Гідрогену до елементів VII групи, яким не вистачає одного електрона для завершення зовнішньої оболонки і які легко приймають чужий електрон з утворенням іонів F-, Сl-, Вr – тощо.
Типовими неметалічними властивостями цей елемент більше подібний до елементів VII групи (Флуор, Хлор, Бром тощо). Але Гідроген не є р-елементом і більш охоче віддає електрон, ніж приймає. Тому його перебування в групі s-елементів – активних відновників – також має сенс. У зв’язку з цим Гідроген часто поміщають у І групу Періодичної таблиці, а в VII групі повторюють його символ у дужках. Але є й такі видання Періодичної таблиці, де його основним місцем є саме VII група. І те й інше – правильно.
Методи добування
У земних умовах Гідроген трапляється переважно у зв’язаному стані, у вигляді сполук із ступенем окиснення +1.
Коли Гідроген уже перебуває у ступені окиснення +1, він може відбирати електрон у багатьох елементів – особливо металів, які схильні віддавати електрони. Тому способи добування водню часто грунтуються на реакції якого-небудь металу з однією із сполук Гідрогену, наприклад:
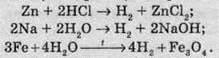
Реакцію між цинком і водним розчином хлоридної кислоти найчастіше використовують для добування водню в лабораторії.
Замість цинку в реакції з НСl можна використовувати інші метали (хоча й не будь-які) – наприклад залізо, олово, магній.
А реакція між залізом і водяною парою при нагріванні має історичне значення – колись її використовували для наповнення воднем повітряних куль.
Рушійною силою подібних реакцій добування водню є не тільки прагнення металів віддати електрон атому Гідрогену у ступені окиснення +1, але й отримати велику кількість енергії у разі скріплення нейтральних атомів Гідрогену, що утворюються при цьому, в молекулу Н2. Тому в реакції такого типу вступають навіть неметали:

Ця реакція лежить в основі промислового способу добування водню. Водяну пару пропускають над розжареним до білого коксом (вугіллям, яке нагрівається без доступу повітря). У результаті утворюється суміш карбон оксиду з воднем, яку називають “водяним газом”.
Водень може утворитись і внаслідок сильного нагрівання метану:
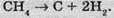
Тому в промисловості велику кількість водню добувають саме з метану, додаючи до нього за високої температури перегріту водяну пару:
1) СН4 + Н2O = СО + 3Н2;
2) СО + Н2O = СO2 + Н2.
У сумі цей процес можна записати рівнянням:
СН4 + 2Н2O = 4 Н2 + СO2.
Суміш газів охолоджують і промивають водою під тиском. При цьому СO2 розчиняється, а малорозчинний у воді водень йде на промислові потреби.
Найчистіший водень у промисловості добувають електролізом води:

Цей спосіб вимагає великих витрат енергії, тому поширений менше, ніж високотемпературна реакція коксу або метану з водою. Існують і інші способи добування водню.
Хімічні властивості Гідрогену
Гідроген – один з рекордсменів за числом різноманіття сполук. Найбільша їхня кількість припадає на сполуки з Карбоном, які вивчає органічна хімія.
Але й неорганічні сполуки Гідрогену дуже різноманітні.
В таблиці наведено приклади сполук Гідрогену з типовими s – і р-елементами, Вказаний ступінь окиснення Гідрогену у всіх сполуках.
Другий період | |||||
Літій гідрид | Берилій гідрид | Метан | Амоніак | Вода | Фтористий водень |
-1 | -1 | +1 | +1 | +1 | +1 |
LiH | ВеH2 | CH4 | NH3 | H2O | HF |
Твердий | Твердий | Газ | Газ | Рідина | Рідина |
Третій період | |||||
Магній гідрид | Силан | Фосфін | Сірководень | Хлористий водень | |
-1 | -1 | -1 | +1 | +1 | |
MgH2 | SiH4 | PH3 | H2S | HCl | |
Твердий | Газ | Газ | Газ | Газ |
Сполуки металів з Гідрогеном (вони називаються гідридами металів) є твердими речовинами. Гідриди металів можна добувати безпосередньо з металу та водню:
Са + Н2 → СаН2 (кальцій гідрид, tпл = 1000 °С)
Гідриди бурхливо реагують з водою з утворенням газуватого водню:
СаН2 + 2Н2O → Са(ОН)2 + 2Н2.
Це ще один зручний спосіб добування газуватого водню. Джерелом атомів Гідрогену є як гідрид металу, так і вода. Тому для добування 1 м3 водню необхідно всього 0,94 кг кальцій гідриду, тоді як для добування тієї ж кількості газу дією металів на кислоти потрібно 2,5 кг заліза або 2,9 кг цинку.
Сполуки Гідрогену з неметалами переважно є газами. Виняток становить вода та фтороводень. Така різка відмінність води від інших летких сполук Гідрогену пояснюється існуванням між молекулами води особливого виду хімічного зв’язку – водневого.
З усіх сполук Гідрогену однією з найважливіших є амоніак, який добувають реакцією водню з азотом за високої температури, тиску й у присутності каталізатора:

Це один з небагатьох хімічних процесів, що дозволяють зв’язувати досить інертний атмосферний азот. Надалі з активнішого в хімічному відношенні амоніаку добувають безліч нітратних сполук – нітратну кислоту, барвники, вибухові речовини, нітратні добрива.
Відновні властивості Гідрогену використовують для добування чистих металів з їхніх оксидів. Наприклад, під час нагрівання купрум(ІІ) оксиду СuО у струмені водню утворюється вода і порошок міді:
СuО + Н2 → Сu + Н2O.
Для деяких дуже тугоплавких металів відновлення їхніх оксидів воднем виявляється зручним і економічним способом добування. Наприклад, метал вольфрам, з якого роблять нитки лампочок розжарювання, добувають за допомогою реакції:
WO3 + 3Н2 → W + 3Н2O.
Метал виходить у вигляді порошку, який потім можна пресувати в готові вироби. Після спікання такі вироби не вимагають подальшої обробки. Цей спосіб добування металів і деталей з них називається порошковою металургією.
Застосування водню
Водень є надзвичайно теплотворним хімічним паливом. Крім того, внаслідок спалювання водню утворюється тільки вода, тоді як інші палива забруднюють атмосферу оксидами Карбону, Нітрогену та незгорілими залишками палива.
Водень використовується як пальне у сучасній ракетній техніці. Ракетоносії здатні виводити на орбіту понад 100 тонн різних вантажів завдяки воднево-кисневим двигунам. У їхніх баках міститься рідкий кисень і рідкий водень.
Суміші водню з киснем називаються гримучим газом і вибухають від найменшої іскри. Тому робота з воднем як паливом вимагає таких заходів обережності, які б виключали можливість вибуху. Сучасна техніка дозволяє досягти високого рівня безпеки, але історія знає трагедії, пов’язані з вибухами водню.
У першій половині століття в різних країнах було побудовано велику кількість літальних апаратів, легших за повітря – дирижаблів.
Дирижаблі – це керовані аеростати зі сигароподібною оболонкою, наповненою воднем. Великий об’єм водню в оболонці забезпечував високу вантажопідйомність цих повітряних кораблів. Найбільші пасажирські дирижаблі 30-х років XX століття могли перевозити до 100 осіб на дуже великі відстані. На цих літальних апаратах були комфортабельні каюти, ресторани, душові, палуби для прогулянок тощо. Такі дирижаблі здійснювали регулярні рейси з Європи до Америки.
Проте велика кількість енергії, що виділяється в реакції водню з киснем, криє в собі величезну небезпеку. 6 травня 1937 року найбільший у світі пасажирський дирижабль “Гінденбург”, що прилетів з Німеччини до Нью-Джерсі (США), вибухнув і впав на землю від іскри, що проскочила між причальною щоглою і корпусом дирижабля. Багато в чому саме через цю катастрофу будівництво пасажирських дирижаблів незабаром припинилося.
У наш час водень не застосовують для наповнення аеростатів та інших літальних апаратів, легших за повітря. Для цих цілей використовують більш дорогий, та проте безпечний газ гелій.