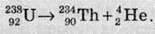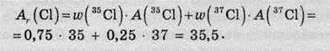Ізотопи
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
БУДОВА АТОМА
Ізотопи
Нукліди й ізотопи
Атомні ядра одного й того самого хімічного елемента містять однакове число протонів, що дорівнює порядковому номеру цього елемента в Періодичній системі. Але якщо протонів в атомних ядрах певного хімічного елемента має бути строго визначене число, то число нейтронів у ядрі таких атомів може бути різним. Наприклад, у ядрі атомів Оксигену міститься 8 протонів (порядковий номер Оксигену в Періодичній системі
Нуклід – це різновид атомів з певним числом протонів і нейтронів у ядрі.
Кожний нуклід характеризують певними числами. Протонне число (або зарядове число, або атомне число) – Z – позначає число протонів у ядрі атома певного нукліда. Нейтронне число – N – указує число нейтронів у ядрі певного нукліда. Масове число – А – це сума протонного та нейтронного чисел:
Масове число = Протонне число +
A = Z + N.
Оскільки маса кожного протона й нейтрона дорівнює приблизно 1 а. о. м., а електрона – дуже мала, то масове число кожного атома приблизно дорівнює його відносній атомній масі, округленій до цілих чисел.
У хімії використовують спеціальні позначення для нуклідів: заряд ядра, тобто протонне число, пишуть ліворуч унизу від символу хімічного елемента, а масове число – ліворуч угорі, наприклад для описаних вище нуклідів Оксигену:
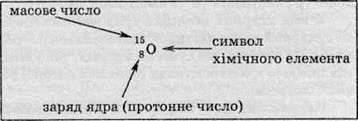
Іноді протонне число випускають і пишуть просто 15О, оскільки й так відомо, що у всіх нуклідів Оксигену протонне число має бути 8. На письмі різні нукліди можна позначати хімічними символами, а можна використовувати назви хімічних елементів, наприклад Оксиген-15 (815О), Оксиген-18 (818О).
Усі нукліди, які мають однаковий заряд (протонне число) і різне нейтронне число, називають ізотопами. Оскільки нукліди з однаковим протонним числом належать до одного хімічного елемента, то: різні нукліди одного хімічного елемента є ізотопами.
Зазвичай нукліди хімічних елементів не мають власних назв, єдиним винятком серед них є Гідроген. Його нукліди позначаються спеціальними символами й мають різну назву. Звичайний Гідроген Н (11Н) – Протій, ядра його атомів складаються тільки з одного протона. Важкий Гідроген D (12H) – Дейтерій, у ядрах його атомів, окрім одного протона, міститься ще один нейтрон. І надважкий Гідроген Т (13Н) – Тритій, у ядрах його атомів, окрім одного протона, міститься два нейтрони.
Визначення складу атомів
Знаючи порядковий номер елемента та масове число нукліда, неважко обчислити, скільки електронів, протонів та нейтронів містить певний атом. Число електронів дорівнює числу протонів Z, що збігається з порядковим номером (зарядом ядра), а число нейтронів N дорівнює різниці між масовим числом А та зарядом ядра:
N = A – Z.
Задача. Скільки протонів, нейтронів та електронів міститься в нукліді Плюмбуму-210?
Розв’язання:
Масове число даного нукліда Плюмбуму дорівнює 210. Оскільки Плюмбум має порядковий номер 82, то в атомі нукліда Плюмбуму-210 міститься 82 протони та 82 електрони. Число нейтронів обчислимо як різницю між масовим числом і числом протонів: N = 210 – 82 = 128.
Відповідь: 82 протони, 128 нейтронів, 82 електрони.
Природні суміші нуклідів
Учені налічують понад 2000 нуклідів. Оскільки хімічних елементів на сьогодні існує понад 100, то багато з відомих нуклідів є ізотопами й можна сказати, що в середньому на кожен елемент припадає близько 10 нуклідів. Але, звісно ж, кожен елемент має різне число нуклідів. Рекордсменами за числом нуклідів є Ксенон і Цезій, кожен із них існує у вигляді 36 нуклідів.
У кожного елемента є природні нукліди, тобто ті, що реально можна знайти в природних умовах. Таких нуклідів налічують близько 300 (у середньому по три на кожний елемент). А інші нукліди добуті штучно.
У природі кожний елемент існує у вигляді суміші кількох нуклідів, наприклад Карбон (12С, 13С і 14С), Нітроген (14N і 15N), Оксиген (16О, 17О, 18О). Рекордсменом за числом природних нуклідів (10) є Станум. Водночас деякі хімічні елементи мають тільки один природний стабільний нуклід, наприклад Флуор (19F), Натрій (23Na), Алюміній (27Аl), Фосфор (31Р).
Значення відносних атомних мас елементів, наведені в періодичній таблиці, не є цілими: Ar(С) = 12,011, Аr(Сl) = 35,453, тим часом як масові числа всіх нуклідів є цілими числами. Це пов’язано з тим, що більшість елементів зустрічаються в природі у вигляді кількох нуклідів, і значення, наведене в таблиці, є середнім, обчисленим з урахуванням процентного вмісту кожного нукліда в земній корі. Так, природний Хлор приблизно на 75% складається з атомів 35Сl і на 25% із атомів 37Сl, тому його атомна маса дорівнює 35,5: