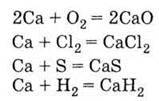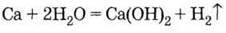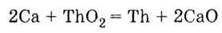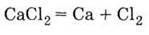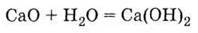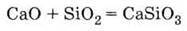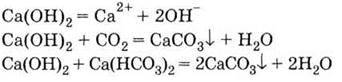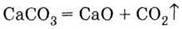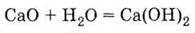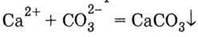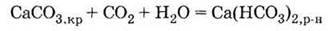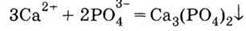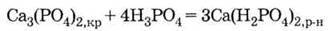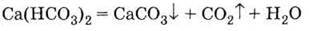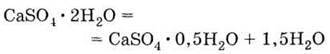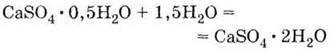КАЛЬЦІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Хімія – універсальний довідник
ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ
КАЛЬЦІЙ
Одна з найважливіших сполук кальцію – оксид СаО (негашене вапно). Його одержують розкладом вапняку (що складається, в основному, з карбонату кальцію) при високій (біля 1000 °С) температурі:
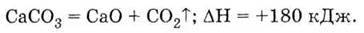
Це – оксид лужноземельного металу, тому він легко взаємодіє з водою, утворюючи луг – гідроксид кальцію:
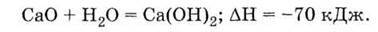
Технічна назва Са(ОН)2 – гашене вапно (реакція його одержання у техніці називається “гасінням вапна”).
Із солями кальцію (а також магнію, заліза і деяких інших багатовалентних металів) – гідрокарбонатами, сульфатами, хлоридами – пов’язане таке поширене явище, як твердість води. Під час кип’ятіння (або впарювання) водного розчину гідрокарбонатів останні розкладаються з утворенням карбонатів, які випадають в осад і утворюють накип, наприклад:
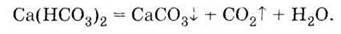
У вигляді накипу осідають не тільки карбонати, але й інші солі, особливо малорозчинні сульфати, які містяться у воді, тому перед використанням її пом’якшують,
Видалити накип можна, обробивши осад карбонатів кислотою (наприклад, оцтовою).
У таблиці подано основні хімічні властивості кальцію і його сполук.
Таблиця
Кальцій і його сполуки
Кальцій | Сполуки Кальцію | |
Оксид і гідрооксид кальцію | Солі кальцію | |
1. Сріблясто-білий метал 2. Активний метал, окислюється простими речовинами:
3. Витісняє водень із води:
4. Витісняє метали з їх оксидів (кальцієтермія):
Одержання Розкладання електричним струмом розплаву хлориду кальцію:
| 1. Порошки білого кольору 2. Оксид кальцію (негашене вапно) проявляє властивості основного оксиду: Взаємодіє з водою з утворенням основи
Взаємодіє з кислотними оксидами
3. Гідроксид кальцію проявляє властивості сильної основи:
Одержання 1. Оксиду – випалюванням вапняку:
2. Гідроксиду – гасінням негашеного вапна:
| 1. Нерозчинний карбонат:
І розчинний гідрокарбонат:
2. Нерозчинний фосфат:
І розчинний дигідрофосфат:
3. Гідрокарбонат розкладається при кип’ятінні або випаровуванні розчину:
4. Обпалений природний гіпс
Твердне при взаємодії з водою, знову утворюючи кристалогідрат:
|