Кількісний склад розчину. Масова частка розчиненої речовини. Приготування розчинів
Тема 1
РОЗЧИНИ
Урок 7
Тема уроку. Кількісний склад розчину. Масова частка розчиненої речовини. Приготування розчинів
Цілі уроку: ознайомити учнів зі способами вираження складу розчинів, поняттями “масова частка розчиненої речовини”, “концентрація”; формувати навички використання цих понять для обчислень і приготування розчинів.
Тип уроку: формування нових знань, умінь і навичок.
Форми роботи: фронтальна бесіда, розв’язання задач.
Обладнання: таблиця розчинності, таблиці із завданнями.
ХІД УРОКУ
I.
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності
Фронтальна бесіда
– Чим відрізняється розчин від механічної суміші?
– Чим відрізняється розчин від хімічної сполуки?
– Чи є склад розчину постійним?
– Які розчини називаються насиченими?
– Які розчини називаються ненасиченими?
– Які розчини називаються концентрованими?
– Які розчини називаються розведеними?
– Запропонуйте способи перетворення насиченого розчину на ненасичений.
– Запропонуйте способи перетворення ненасиченого розчину на насичений.
–
– Що станеться, якщо помістити кристалик твердої речовини в насичений розчин?
– Що станеться, якщо помістити кристалик твердої речовини в пересичений розчин?
– Скільки кристалізаційної води міститься в 1 кг мідного купоросу CuSO4 – 7H2O?
Розв’язання
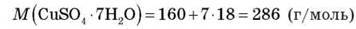
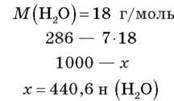
– Як приготувати розчин?
– Як визначити склад розчину?
ІІІ. Вивчення нового матеріалу
Способи вираження складу розчинів
Склад розчину кількісно виражається концентрацією, співвідношенням кількості розчиненої речовини й розчинника.
Найчастіше використовується масова частка розчиненої речовини (відсоткова концентрація), яку можна обчислити за формулою:
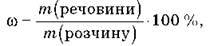
Де m(речовини) – маса розчиненої речовини, г;
M(розчину) = m(речовини) + m(розчинника) – маса розчину, г.
Використовуючи цю формулу, можна обчислити масу речовини й розчину:
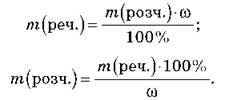
Масова частка розчиненої речовини – безрозмірна величина, виражається в частках від одиниці або відсотках.
IV. Керована практика (виконання тренувальних вправ)
Задача 1
Обчисліть масову частку розчиненої речовини в розчині, одержаному в результаті змішування 20 г цукру і 130 г води.
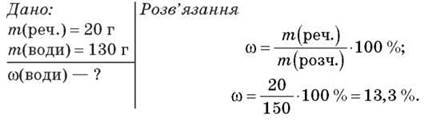
Відповідь: 13,3 %.
Задача 2
(Самостійно за варіантами заповнюємо таблицю для самоперевірки.)
Обчисліть масову частку речовини в розчині, одержаному в результаті змішування:
Варіант | M(реч.), г | M(води), г | M(розч.), г | ?, % |
1 | 30 | 170 | ||
2 | 50 | 100 | ||
3 | 5 | 95 | ||
4 | 100 | 100 | ||
5 | 70 | 130 | ||
6 | 25 | 175 |
Задача 3
Обчисліть, яку масу натрій хлориду й води необхідно взяти для приготування 200 г розчину з масовою часткою розчиненої речовини 10 %.
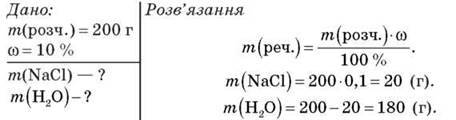
Відповідь: 20 г NaCl, 180 г H2O.
Задача 4
(Самостійно за варіантами)
Варіант | M(реч.), г | M(води), г | M(розч.), г | ?, % |
1 | 120 | 5 | ||
2 | 200 | 12 | ||
3 | 300 | 7 | ||
4 | 150 | 15 | ||
5 | 400 | 25 | ||
6 | 200 | 18 |
V. Самостійна робота за варіантами
Варіант І | Варіант ІІ |
Задача 1 | |
Обчисліть масову частку розчиненої речовини, якщо для приготування розчину взяли | |
20 г калій нітрату і 140 г води. | 70 г сульфатної кислоти та 110 г води. |
Задача 2 | |
Обчисліть масу солі й води, необхідні для приготування розчину | |
Масою 400 г з масовою часткою розчиненої речовини – 15 %. | Масою 500 г з масовою часткою роз чиненої речовини – 17 %. |
VI. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів, проводить обговорення результатів самостійної роботи.
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, заповнити таблицю:
Речовина | M(реч.), г | M(води), г | M(розч.), г | ?, % |
K2SO4 | 75 | 15 | ||
NaNO3 | 20 | 70 | ||
NaOH | 50 | 200 | ||
H2SO4 | 70 | 98 |