Кількість зіткнень і середня довжина вільного пробігу молекул. Ефективний діаметр молекули
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 5 ЯВИЩА ПЕРЕНЕСЕННЯ
5.1. Кількість зіткнень і середня довжина вільного пробігу молекул. Ефективний діаметр молекули
Середні швидкості молекул газу дуже великі – близько сотень метрів за секунду за звичайних умов. Наприклад, за температури 0 °С для молекул водню, азоту і кисню величина 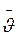 дорівнює відповідно 1700 м/с, 455 і 425 м/с. Однак процес вирівнювання неоднорідності в газах унаслідок молекулярного руху відбувається надто повільно, оскільки процеси
дорівнює відповідно 1700 м/с, 455 і 425 м/с. Однак процес вирівнювання неоднорідності в газах унаслідок молекулярного руху відбувається надто повільно, оскільки процеси
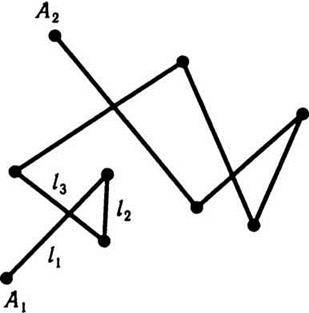
Рис. 5.1
Для оцінення швидкості руху молекул вводиться поняття середньої довжини шляху, який молекула проходить без зіткнень (позначається 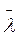 ). Для підрахунку цього шляху беруть суму довжин відрізків траєкторії l1, l2, l3,…, ln від зіткнення до зіткнення і цей загальний шлях ділять на кількість відрізків п, яка дорівнює кількості зіткнень, тобто
). Для підрахунку цього шляху беруть суму довжин відрізків траєкторії l1, l2, l3,…, ln від зіткнення до зіткнення і цей загальний шлях ділять на кількість відрізків п, яка дорівнює кількості зіткнень, тобто
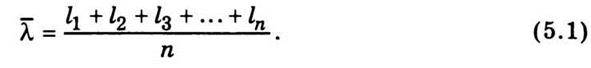
За цією формулою визначають середній шлях, який молекула проходить вільно від зіткнення до зіткнення і який називається середньою довжиною вільного пробігу молекул.
Для визначення 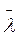 визначимо спочатку кількість зіткнень обраної молекули з іншими молекулами за одиницю часу.
визначимо спочатку кількість зіткнень обраної молекули з іншими молекулами за одиницю часу.
Вважатимемо, що молекула після зіткнення продовжує рухатися по прямій із середньою швидкістю руху 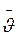 . Молекули, з якими стикається обрана молекула, в першому наближенні вважаємо нерухомими і беремо їх за сферичні частинки радіуса r (рис. 5.2). Нехай обрана молекула рухається вправо із положення А1 в положення А2 по прямій O1O2. Під час руху вона стикається з тими нерухомими молекулами, центри яких лежать не далі ніж 2r від траєкторії руху O1O2 (наприклад, молекула В з центром О). Тобто молекула, що рухається зі швидкістю
. Молекули, з якими стикається обрана молекула, в першому наближенні вважаємо нерухомими і беремо їх за сферичні частинки радіуса r (рис. 5.2). Нехай обрана молекула рухається вправо із положення А1 в положення А2 по прямій O1O2. Під час руху вона стикається з тими нерухомими молекулами, центри яких лежать не далі ніж 2r від траєкторії руху O1O2 (наприклад, молекула В з центром О). Тобто молекула, що рухається зі швидкістю 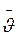 протягом 1 с, зіткнеться з тими молекулами, центри яких лежать усередині циліндра з віссю O1O2 і які мають радіус 2r і довжину, що дорівнює
протягом 1 с, зіткнеться з тими молекулами, центри яких лежать усередині циліндра з віссю O1O2 і які мають радіус 2r і довжину, що дорівнює 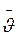 . Справді, за одиницю часу молекула проходить відстань, що дорівнює значенню середньої швидкості руху молекул газу
. Справді, за одиницю часу молекула проходить відстань, що дорівнює значенню середньої швидкості руху молекул газу 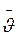 . Тому об’єм циліндра, в якому містяться задані молекули, буде 4πr2
. Тому об’єм циліндра, в якому містяться задані молекули, буде 4πr2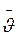 .
.
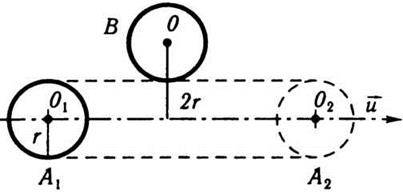
Рис. 5.2
Якщо концентрація молекул становить n0, то всередині заданого циліндра міститься число молекул, яке дорівнює z = 4πr2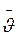 N0. Це число z і визначає середню кількість зіткнень за одиницю часу. Оскільки інші молекули також перебувають у русі, то в це число вводять поправочний множник, що дорівнює
N0. Це число z і визначає середню кількість зіткнень за одиницю часу. Оскільки інші молекули також перебувають у русі, то в це число вводять поправочний множник, що дорівнює 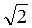 . Тому середню кількість зіткнень за одиницю часу визначають за формулою
. Тому середню кількість зіткнень за одиницю часу визначають за формулою

Щоб визначити середню довжину вільного пробігу молекул, потрібно шлях, який проходить молекула за одиницю часу (чисельно він дорівнює 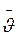 ), поділити на кількість відповідних відрізків шляху, тобто на середню кількість зіткнень z за одиницю часу:
), поділити на кількість відповідних відрізків шляху, тобто на середню кількість зіткнень z за одиницю часу: 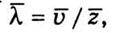 Або
Або

Отже, середня довжина вільного пробігу 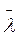 не залежить від температури газу, оскільки з підвищенням Т одночасно збільшуватиметься
не залежить від температури газу, оскільки з підвищенням Т одночасно збільшуватиметься 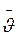 i
i 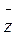 .
.
Значення середньої довжини вільного пробігу використовується, наприклад, при описанні дифузії, теплопровідності та інших явищ.
При визначенні кількості зіткнень і середньої довжини вільного пробігу молекул у першому наближенні за модель молекули взято пружну кульку.
Насправді кожна молекула є складною системою елементарних частинок, і під час розгляду пружного зіткнення молекул бралося до уваги, що центри молекул можуть зблизитися до деякої найменшої відстані. Після цього виникають сили відштовхування, які спричинюють взаємодію, подібну до взаємодії при пружному ударі. Середню відстань між центрами молекул, які взаємодіють так само, як при пружному ударі, називають ефективним діаметром.
Якщо у формулу (5.3) ввести ефективний діаметр σ = 2r, то дістанемо такий вираз:

Для оцінення величини 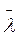 , наведемо такий приклад. Для азоту за нормальних умов (тиск 1 атм, температура 273 К)
, наведемо такий приклад. Для азоту за нормальних умов (тиск 1 атм, температура 273 К) 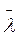 ≈ 0,6 ∙ 10-7 м. Це приблизно у 1000 разів більше від розмірів молекул. Отже, час “взаємодії” молекул під час зіткнень у стільки ж разів (
≈ 0,6 ∙ 10-7 м. Це приблизно у 1000 разів більше від розмірів молекул. Отже, час “взаємодії” молекул під час зіткнень у стільки ж разів (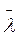 /σ) менший, ніж час їхнього вільного руху. Таким чином, зіткнення навіть при атмосферному тиску є досить рідкісним явищем.
/σ) менший, ніж час їхнього вільного руху. Таким чином, зіткнення навіть при атмосферному тиску є досить рідкісним явищем.
Як бачимо з формули (5.4), 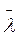 ~ 1 / р, оскільки Т = соnst, а р ~ n0. За відповідних значень р (порівняно малих) значення
~ 1 / р, оскільки Т = соnst, а р ~ n0. За відповідних значень р (порівняно малих) значення 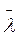 можуть зрівнятися з розмірами посудини, в якій зберігається газ. Це означає, що газ перебуває у стані вакууму. З формули (5.4) випливає, що
можуть зрівнятися з розмірами посудини, в якій зберігається газ. Це означає, що газ перебуває у стані вакууму. З формули (5.4) випливає, що 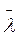 молекул залежить також від їхнього діаметра. Точні розрахунки і експерименти засвідчують, що визначальним при цьому є ефективний діаметр а, який залежить від температури. За Г. Сезерлендом (1859-1912), ця залежність описується формулою
молекул залежить також від їхнього діаметра. Точні розрахунки і експерименти засвідчують, що визначальним при цьому є ефективний діаметр а, який залежить від температури. За Г. Сезерлендом (1859-1912), ця залежність описується формулою

Де σ0 – істинний діаметр молекули; С – стала Сезерленда. Значення С, визначені із дослідних даних щодо в’язкості газів, показали, що С є не сталою величиною, а деякою функцією температури. Для розрахунку С з експериментальних даних рівняння Сезерленда застосовують у такій формі:

Де А = 2,7 ∙ 10-21 – універсальна константа. Будуючи графік залежності Т3/2/η від температури, дістанемо пряму, яка відтинає на осі температури відрізок, що дорівнює С. Визначені таким чином значення С істотно залежать від помилки у визначенні η. Так, помилка в 1 % при визначенні η спричинює помилку у визначенні С до 10 % . Величину С можна взяти сталою з деяким наближенням тільки для обмеженого інтервалу температур. У табл. 5.1 наведено значення С для деяких газів із зазначенням інтервалів температур, в яких можна користуватися цими значеннями.
Таблиця 5.1. Значення константи Сезерленда для різних газів
Газ | Константа Сезерленда | Температура, ºС | Газ | Константа Сезерленда | Температура, ºС |
Гелій | 83 | 100…200 | Ксенон | 252 | 0…100 |
95 | 200 …250 | Водень | 73 | 20…100 | |
173 | 682…815 | 86 | 100…200 | ||
Неон | 61 | 20…100 | 105 | 200…250 | |
70 | 100…200 | Азот | 103,9 | 25…280 | |
82 | 200…250 | 104,7 | 20…825 | ||
128 | 686 …827 | Кисень | 126,6 | 20…280 | |
Аргон | 142 | 20…827 | Метан | 164 | 20…250 |
Криптон | 188 | 0…100 |
Була спроба встановити аналітичний вираз, який зв’язував би константу Сезерленда з іншими фізичними константами. Встановлено, що С пропорційна критичній температурі Тк і зв’язок з нею виражається співвідношенням С = ТК /1,12, а також пропорційна температурі кипіння Тs при атмосферному тиску. Зв’язок С з Тs виражається співвідношенням С = 1,47Тs.
Хоча ці правила є емпіричними, вони все ж можуть бути корисними для наближених розрахунків С.