Кислотна корозія – Корозія
ОКИСНЕННЯ І ВІДНОВЛЕННЯ
2 . Корозія
2.1 . Кислотна корозія
Водні розчини кислот не можна перевозити або зберігати в металевих ємкостях, бо вони можуть вступати в реакцію з кислотою, і в результаті цього можуть протікати.
Приклад. Хлоридна кислота реагує із залізом з виділенням водню:
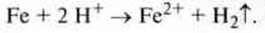
Реакція металів з іонами гідроксонію1 є окисно-відновною реакцією: атом металу віддає електрони, тобто окислюється, а протон отримує електрон, тобто відновлюється. Такі метали, як, наприклад, мідь, срібло і золото такій
З іншого боку, сполуки цих металів мають схильність окислювати водень та інші метали.
Водень і метали мають різну здатність віддавати електрони. Відповідно їхні іони мають різну здатність отримувати електрони. На цій основі можна записати окисно-відновний ряд:
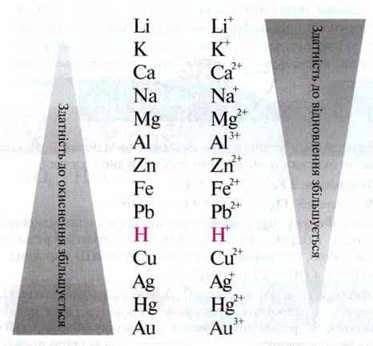
Метали, які мають меншу здатність, ніж водень, віддавати електрони, називають благородними металами. Метали, які мають більшу здатність, ніж водень, віддавати електрони, називають неблагородними металами.
Запам’ятайте: предмети з неблагородних металів окислюються під впливом кислих рідин. Цей процес називають кислотною корозією.
__________________________________________________________________
1 Для спрощення розглядається як протон (Н+).
Related posts:
- Контактна корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.3. Контактна корозія Процеси контактної корозії відбуваються там, де два різні метали знаходяться у безпосередньому контакті між собою і стикаються з розчином електроліту або середовищем, що містить кисень. У цьому випадку між ними виникає так званий локальний гальванічний елемент. При цьому корозії піддається метал, який в окисно-відновному ряді має […]...
- Корозія металів – Метали Хімія Неорганічна хімія Метали Корозія металів Корозія – руйнування металу під дією навколишнього середовища. Це окисно-відновний процес. Хімічна корозія – руйнування металу під час його окиснення без виникнення електричного струму в системі. При цьому метал взаємодіє з газами (газова корозія) і рідкими неелектролітами (бензин, нафта, толуол та ін.). Наприклад, сполука металів із киснем повітря. Електрохімічна […]...
- Хімічна корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія Хімічна корозія Хімічна корозія – це процес руйнування металів або їхніх сплавів внаслідок хімічного впливу. Приклад. Метал вихлопних труб внаслідок впливу кислих вихлопних газів стає крихким. Залізо починає іржавіти на вологому повітрі....
- КОРОЗІЯ МЕТАЛІВ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ КОРОЗІЯ МЕТАЛІВ Корозія металів – окисно-відновний процес, який призводить до руйнування металу. Корозія відбувається за рахунок роботи багатьох мікро гальванічних елементів. Атмосферна корозія протікає під впливом атмосферних опадів. На поверхні металу певного виробу завжди є плівка електроліту – вологи, в якій присутні розчинені […]...
- Механічна корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія Корозія – це процес руйнування речовини, що викликаний зовнішніми чинниками. Принципово розрізняються два види корозії. Механічна корозія Механічна корозія – це процес руйнування, викликаний коливаннями тиску і температурі:, а також механічною дією. Приклад. Замерзла вода на асфальтованих дорогах пошкоджує їх. Під час інтенсивного руху відбувається посилене коливання мостів, внаслідок […]...
- Киснева корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.2. Киснева корозія Залізо – один із найважливіших матеріалів, який, на жаль, має здатність іржавіти на вологому повітрі. На першому етапі в процесі окисно-відновної реакції залізо окислюється, а кисень повітря відновлюється. Окиснення: Відновлення: Іони Феруму, що утворюються під час окисно-відновної реакції і гідроксид-іони рухливі та вступають у реакцію між […]...
- Ряд електрохімічних потенціалів металів ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.12. Ряд електрохімічних потенціалів металів Порівняльну активність металів в окисно-відновних реакціях, які відбуваються у водних розчинах речовин, характеризує електрохімічний ряд напруг металів (ряд електрохімічних потенціалів, витискувальний ряд, ряд активності). Електрохімічний ряд напруг – це розташування металів у послідовності збільшення […]...
- ЗАГАЛЬНІ ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ. КОРОЗІЯ МЕТАЛІВ ТА ЇХ ЗАХИСТ ВІД КОРОЗІЇ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 3. ЗАГАЛЬНІ ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ. КОРОЗІЯ МЕТАЛІВ ТА ЇХ ЗАХИСТ ВІД КОРОЗІЇ Цілі: вивчити загальні хімічні властивості металів; мати уявлення про корозію металів і способи захисту металів від корозії; вміти складати рівняння хімічних реакцій, що ілюструють хімічні властивості металів і суть корозії металів, складати рівняння реакцій з […]...
- БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ Лужними металами називаються елементи ІА групи. Якщо галогени є типовими, найяскравіше вираженими неметалами, то елементи ІА групи – це типові метали. БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ З елемента ІА групи розпочинається кожен період у таблиці Д. І. Менделєєва. Це означає, що саме в атомах цих елементів розпочинається заповнення наступного енергетичного […]...
- Загальні хімічні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.3. Загальні хімічні властивості металів Найтиповіша ознака металічних елементів – це здатність відносно легко віддавати електрони: 1. Взаємодія металів з простими речовинами (неметалами): А) з галогенами. Утворюються відповідні […]...
- Електрохімічний ряд напруг металів – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.2. Електрохімічний ряд напруг металів Щоб використовувати окисно-відновну реакцію, яка проходить між металом і іонами менш активного металу, для отримання електричної енергії, також потрібно провести просторове розділення “партнерів” окисно-відновної реакції. Приклад. Якщо пластинку заліза помістити в розчин, що містить іони Феруму, а мідну пластинку в розчин, який містить іони Купруму, […]...
- Корозія металів – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ § 12.7. Корозія металів Під час експлуатації виробів з металів та їх сплавів доводиться стикатися з явищем руйнування їх під дією навко яишнього середовища. Руйнування металів і сплавів внаслідок взаємодії їх з навколишнім середовищем називається корозією. Корозія […]...
- Корозія металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.4. Корозія Металів Корозія (від лат. corrosio – роз’їдання) – це самовільний процес руйнування металів при взаємодії з навколишнім середовищем. Розрізняють кілька видів корозії, з яких найважливішими є […]...
- Елементи-метали в Періодичній системі – Метали Хімія Неорганічна хімія Метали Елементи-метали в Періодичній системі Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: – мале число електронів на зовнішньому енергетичному […]...
- Металічний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.2. Металічний зв’язок Слабо електронегативні атоми металів мають велику здатність віддавати електрони і ставати позитивними іонами. Тому вони формують металічні гратки без участі негативних іонів. Валентні електрони, віддані атомами металу, оточують позитивно заряджені іони металу й утримують гратку електростатичними силами. Запам’ятайте: у металічному зв’язку, на відміну від інших […]...
- Загальні способи добування металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Загальні способи добування металів Лабораторні методи добування А) відновлення оксидів металів воднем; таким способом зазвичай добувають не дуже активні метали, які не взаємодіють із воднем: Б) розкладання оксидів важких металів: В) витіснення металів з їхніх солей більш активними металами: Добування […]...
- РЯД АКТИВНОСТІ МЕТАЛІВ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ РЯД АКТИВНОСТІ МЕТАЛІВ За числовим значенням своєї відновної здатності всі метали можуть бути розташовані в ряд, який називається р я д о м активності мета л і в. Його називають ще електрохімічним рядом, підкреслюючи тим самим, що, вступаючи в хімічну реакцію, метал віддає електрони – носії електричного струму. […]...
- Корозія металів РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 56. Корозія металів Усвідомлення змісту цього параграфа дає змогу: формулювати означення корозії; Пояснювати суть хімічної й електрохімічної корозії та захисту металів від неї; Складати рівняння та схеми електронного балансу відповідних хімічних реакцій; Висловлювати судження про наслідки корозії металів. Ви уже знаєте, що металеві вироби руйнуються під впливом […]...
- Корозія металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Корозія металів Корозією зазвичай називають мимовільне руйнування металів у результаті їхньої хімічної й електрохімічної взаємодії із зовнішнім середовищем та перетворення їх у стійкі сполуки (оксиди, гідроксиди, солі). Власне кажучи, корозія являє собою сукупність окисно-відновних процесів, які відбуваються при контакті металів […]...
- Захист від корозії – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.4. Захист від корозії Щоб захистити метали від корозії, їх покривають шаром більш активного металу. Захисна функція зберігається і в тому випадку, якщо захисний шар має пошкодження або тріщини. Приклад. Оцинковані залізні труби краще захищені від іржі, ніж неоцинковані. Якщо кородувальне середовище стикається із залізом, то залізо отримує захист […]...
- Місце елементів-неметалів у Періодичній системі – ГАЛОГЕНИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЯ ЕЛЕМЕНТІВ ГАЛОГЕНИ Місце елементів-неметалів у Періодичній системі Усі елементи в Періодичній системі Д. І. Менделєєва умовно можна розділити на два типи: металічні і неметалічні. До неметалічних відносять елементи, які схильні приймати електрони, а до металічних – елементи, які схильні їх віддавати. Як […]...
- Загальні хімічні властивості металів – ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ Загальні хімічні властивості металів В атомах металів на зовнішній електронній оболонці утримується невелике число електронів. Ці електрони порівняно легко можуть відриватися від атомів. Така особливість металів є причиною не тільки їхніх фізичних, але й хімічних властивостей. Виходячи з того, що […]...
- Поняття про сплави. Корозія металів. Захист від корозії ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 27 Тема уроку. Поняття про сплави. Корозія металів. Захист від корозії Цілі уроку: ознайомити учнів з поняттям “сплави”, їхнім складом, властивостями, процесом руйнування металів під дією навколишнього середовища, основними способами захисту металів від корозії; продовжити формування вмінь і навичок складання рівнянь окисно-відновних реакцій […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Рівновага в окисно-відновних реакціях – Окисно-відновні реакції ОКИСНЕННЯ І ВІДНОВЛЕННЯ 1. Окисно-відновні реакції Окисно-відновна реакція складається з двох напівреакцій: напівреакції окиснення і напівреакції відновлення. Окиснення – це віддача електронів, відновлення – отримання електронів. Приклад. При згоранні магнію атоми Магнію окислюються, а молекули кисню відновлюються. При цьому кожен атом Магнію віддає два електрони кожному атому Оксигену. 1.1. Рівновага в окисно-відновних реакціях На відміну […]...
- КОРОЗІЯ Екологія – охорона природи КОРОЗІЯ – 1) будь-яке самовільне руйнування об’єктів під впливом хім. агентів або фіз.-хім. чинників зовн. середовища. Розрізняють хім., ел. – хім., атм., грунт., мор. та ін. види К.; 2) руйнування живої тканини виразковими процесами або їдкими речовинами; 3) іржавіння, руйнування поверхні мет. виробів і конструкцій під впливом хім. або ел.-хім. процесів; […]...
- Фізичні властивості металів – Метали Хімія Неорганічна хімія Метали Фізичні властивості металів Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал – золото. Марганець і бісмут – крихкі метали. Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал. […]...
- ЗАБРУДНЕННЯ ВАЖКИМИ МЕТАЛАМИ Екологія – охорона природи ЗАБРУДНЕННЯ ВАЖКИМИ МЕТАЛАМИ – процес локального, регіонального і глобального нагромадження свинцю, ртуті, кадмію та ін. важких металів на поверхні Землі. Шляхи потрапляння цих металів у середовище різні (тертя мет. деталей, корозія, викиди двигунів внутр. згоряння, тепло – енергет. пристроїв тощо), але нагромаджуються вони в основному внаслідок вилучення їх із надр землі […]...
- Хімічні властивості металів – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ § 12.3. Хімічні властивості металів Атоми металів порівняно легко віддають валентні електрони і перетворюються на позитивно заряджені іони. Тому метали є відновниками. В цьому, власне, і полягає їх головна і найзагальніша хімічна властивість. Рис. 12.2. Криві температур […]...