Головна ⇒ 📌Довідник з хімії ⇒ МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
Хімія – універсальний довідник
БУДОВА РЕЧОВИНИ
ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ
МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА
Просторова конфігурація молекули визначається відштовхуванням електронних пар центрального атома:
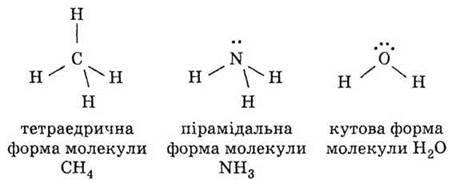
Просторове розташування чотирьох електронних пар умовно відповідає знаходженню їх у вершинах тетраедра (рис.9).
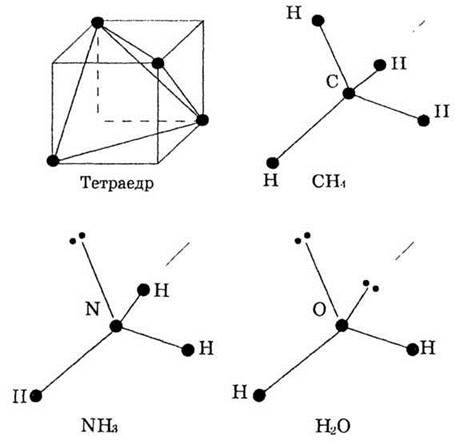
Рис. 9. Міжелектронне відштовхування і структура молекул СН4, NН3, Н20.
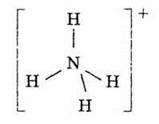
Тетраедричну конфігурацію має також іон амонію NH4+:
Просторове розташування шести електронних пар центрального атома відповідає октаедричній формі молекули SF6 і пірамідальній формі молекули СlF5 (рис. 10).
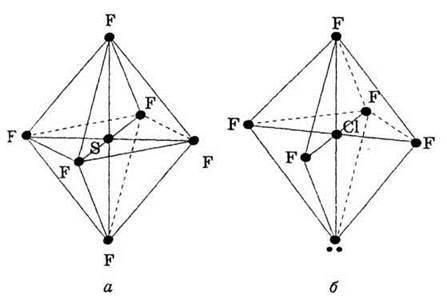
Рис. 10. Октаедрична форма молекули SF6 (а) і пірамідальна форма молекули СlF5 (б).
Related posts:
- МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ МОДЕЛЬ ГІБРИДИЗАЦІЇ ВАЛЕНТНИХ ОРБІТАЛЕЙ ЦЕНТРАЛЬНОГО АТОМА Характер гібридизації валентних орбіталей центрального атома і їхнє просторове розташування визначають просторову конфігурацію молекул і комплексних іонів (рис. 11). Рис. 11. Гібридизація s – і р-валентних орбіталей. Відповідно до моделі гібридизації орбіталей центрального атома молекула СO2 має лінійну форму, іон […]...
- КОМПЛЕКСОУТВОРЕННЯ – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ КОМПЛЕКСОУТВОРЕННЯ Комплексні іони складаються з центрального іона, зв’язаного зі здатними до самостійного існування молекулами або іонами: Координаційні сполуки: Комплексний іон 2+ має тетраедричну форму, а комплексний іон 4 – октаедричну (рис. 12). Рис. 12. Тетраедрична форма комплексного іона 2+ (а) і октаедрична форма комплексного іона 4- […]...
- Гібридизація електронних орбіталей ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.4. Гібридизація електронних орбіталей Під час утворення молекул з ковалентним полярним зв’язком у деяких атомів відбувається характерне явище, яке називають гібридизацією електронних орбіталей – перетворення електронних орбіталей різного виду (s, р)1 на однакові за формою та енергією гібридні орбіталі. Sp3-гібридизація […]...
- ВЗАЄМОДІЯ МОЛЕКУЛ Розділ 2. БУДОВА РЕЧОВИНИ §9.РУХ і ВЗАЄМОДІЯ МОЛЕКУЛ 2. ВЗАЄМОДІЯ МОЛЕКУЛ Про взаємодію молекул свідчить уже саме існування рідин і твердих тіл. ПРИТЯГАННЯ МОЛЕКУЛ Якби молекули не притягались одна до одної, усі тіла відразу розсипалися б на окремі молекули, перетворившись на гази: газоподібний стан речовини якраз і відповідає порівняно слабкій взаємодії молекул. Молекули різних тіл […]...
- Обмеженість моделі атома Бора – Модель атома Бора БУДОВА АТОМА 4. Модель атома Бора Обмеженість моделі атома Бора – Постулати Бора теоретично не можуть бути обгрунтовані. – Модель атома Бора можна лише умовно перенести на системи з декількома електронами, тобто на інші елементи, для яких точні розрахунки і пояснення властивостей неможливі....
- Досягнення моделі будови електронних оболонок атомів – Модель будови електронних оболонок атомів БУДОВА АТОМА 5 . Модель будови електронних оболонок атомів Основні припущення теорії Бора можна перенести в якісному відношенні на прості системи з декількома валентними електронами, наприклад, такі як атоми лужних металів. – Електрони розташовуються навколо ядра на оболонках (шарах). – Усього в атомах розрізняють до семи оболонок (шарів). – Кожна оболонка є певним рівнем енергії […]...
- Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону І СЕМЕСТР Тема 2. ВУГЛЕВОДНІ Урок 6 Тема уроку. Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону Цілі уроку: формувати в учнів знання про походження ковалентного карбон-карбонового зв’язку в органічних сполуках та його значення в органічній хімії; ознайомити учнів з поняттям “гібридизація електронних орбіталей” в атомі Карбону, видами […]...
- ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Фізика підготовка до ЗНО комплексне видання КВАНТОВА ФІЗИКА. ЕЛЕМЕНТИ ТЕОРІЇ ВІДНОСНОСТІ 3. АТОМ ТА АТОМНЕ ЯДРО 3.1. ПЛАНЕТАРНА МОДЕЛЬ АТОМА РЕЗЕРФОРДА Резерфорд на підставі спостережень за розсіюванням α-частинок при проходженні їх через золоту фольгу обгрунтував модель атома (рис. З, а, б). Планетарна (ядерна) модель атома Резерфорда Атом складається з ядра, яке займає дуже малий об’єм […]...
- МАСА АТОМІВ І МОЛЕКУЛ Фізика підготовка до ЗНО комплексне видання МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА 1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ 1.3. МАСА АТОМІВ І МОЛЕКУЛ Маси атомів і молекул прийнято порівнювати з 1/12 маси атома ізотопу Карбону 126С. Відносною молекулярною масою Мr називають відношення маси молекули mo до 1/12 маси атома Карбону m0с (атомної одиниці маси, а. о. м.): Де Мr […]...
- МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА АТОМНА І ЯДЕРНА ФІЗИКА Розділ 5 Атомна і ядерна фізика § 45. МОДЕЛЬ АТОМА ГІДРОГЕНУ ЗА БОРОМ. ТРУДНОЩІ ТЕОРІЇ БОРА Використовуючи закони механіки І. Ньютона і правило квантування, яке визначає можливі стаціонарні стани, Н. Бор зумів розрахувати допустимі радіуси орбіт електрона і енергії стаціонарних станів, які мають свій порядковий номер 1, 2, 3… . Мінімальний […]...
- Стійкість електронних шарів. Перетворення атомів на йони – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.3. Стійкість електронних шарів. Перетворення атомів на йони Найстійкішою електронною конфігурацією атома є така, при якій у зовнішньому електронному шарі розміщується 2 (як р атома Гелію) або 8 е – (як в атомах інших інертних газів). […]...
- Будова речовини. Будова атома. Залежність швидкості руху атомів і молекул від температури тіла. Дифузія. Лабораторна робота № 6 “Дослідження явища дифузії в рідинах і газах” Розділ 2. БУДОВА РЕЧОВИНИ УРОК № 10 ТЕМА. Будова речовини. Будова атома. Залежність швидкості руху атомів і молекул від температури тіла. Дифузія. Лабораторна робота № 6 “Дослідження явища дифузії в рідинах і газах” Мета: сформувати уявлення про атоми та молекули, залежність швидкості їх хаотичного руху від температури, ознайомити з явищем дифузії; розвивати в учнів уміння […]...
- Рух і взаємодія молекул МЕХАНІКА РОЗДІЛ 1. ФІЗИКА ЯК ПРИРОДНИЧА НАУКА. МЕТОДИ НАУКОВОГО ПІЗНАННЯ § 10. Рух і взаємодія молекул Запитання до вивченого 1. Рух дуже дрібних твердих частинок у рідині, яке першим спостерігав у 1827 р. англійський ботанік Роберт Броун (1773-1858), розглядаючи в мікроскоп спори рослин, що перебувають у рідині, називають броунівським рухом. Причиною броунівського руху є безперервний […]...
- ПРОСТОРОВА СТРУКТУРА ПОПУЛЯЦІЇ Екологія – охорона природи ПРОСТОРОВА СТРУКТУРА ПОПУЛЯЦІЇ – див. Популяція, просторова структура....
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- Зображення орбіталей БУДОВА АТОМА 6 . Хвильова модель 6.2 . Зображення орбіталей Щоб наочно показати конфігурацію електронів атома, Л. Паулі запропонував зображувати його орбіталі у вигляді електронних комірок. Електрони в них зображають вертикальними стрілками. Для розпізнавання спінового квантового числа стрілки направлені у протилежних напрямах. Запам’ятайте: два електрони з протилежним спіном, які знаходяться на одній і тій самій […]...
- Досягнення моделі Бора – Модель атома Бора БУДОВА АТОМА 4. Модель атома Бора Поштовхом для подальшого розвитку моделі атома Нільсоном Бором став відкритий у 1885 році Дж. Бальмером факт, що довжини хвиль усіх ліній видимого спектра газоподібного водню можна обчислити простою математичною формулою: λ – довжина хвилі лінії спектра; RН – стала Рідберга; N – порядкове число (n > 2). N λ/нм […]...
- Поняття про радіус атома – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Поняття про радіус атома Атоми не мають чітко визначених меж, що зумовлено хвильовою природою електронів. У розрахунках користуються ефективними Й уявними радіусамИ, тобто радіусами шароподібних атомів, зближених між собою під час утворення кристала. Їх розраховують за допомогою рентгенометричних даних. Чим більший атомний радіус, тим слабкіше утримуються […]...
- Тема 8. Будова електронної оболонки атома – ПЕРІОДИЧНИЙ ЗАКОН ТА ПЕРІОДИЧНА СИСТЕМА Д. І. МЕНДЕЛЄЄВА Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ ПЕРІОДИЧНИЙ ЗАКОН ТА ПЕРІОДИЧНА СИСТЕМА Д. І. МЕНДЕЛЄЄВА Тема 8. Будова електронної оболонки атома Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте число електронів, що може міститися на р-підрівні електронної оболонки атомів: A. 2; Б. 3; B. 6; Г. […]...
- Ядерна модель (модель Резерфорда) БУДОВА АТОМА 3. Ядерна модель (модель Резерфорда) При опроміненні найтоншої золотої фольги α-частинками більшість частинок проходить через фольгу по прямій лінії, деякі з них відхиляються на різні кути, а приблизно 1 частинка зі 100 000 відбивається назад. Результати цього експерименту з розсіювання α-частинок, проведеного в 1911 році, неможливо пояснити моделлю Томсона. Ядерна модель Резерфорда заперечує […]...
- Будова електронних оболонок та властивості хімічних елементів Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок та властивості хімічних елементів Металічні й неметалічні елементи Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. В атомах елементів головних підгруп валентними е електрони зовнішнього енергетичного рівня. Завершені […]...
- МОЛЕКУЛЯРНА БУДОВА РІДИН Розділ 2. БУДОВА РЕЧОВИНИ §11 . РІДИНИ 2. МОЛЕКУЛЯРНА БУДОВА РІДИН Схематично розташування молекул у рідині показано на рис. 11.4. Молекули в рідині розташовані впритул одна до одної, але в цьому розташуванні немає певного порядку. Як ви бачите, розташування молекул у рідині нагадує розташування піщин у купі піску. Саме цим і зумовлено згадану вище подібність […]...
- МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНИЙ ЗВ’ЯЗОК МОЛЕКУЛИ АЗОТУ N2, КИСНЮ O2 І ФТОРУ F2 Енергетична діаграма орбіталей двохатомних молекул елементів другого періоду наведена на рис. 6. Рис. 6. Енергетична діаграма орбіталей двохатомних молекул s – і р-елементів. Користуючись рис. 6, можна скласти електронні конфігурації двохатомних s – і р-елементів. Електронна конфігурація Структурна Молекули […]...
- КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ – КРИСТАЛИ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ КРИСТАЛИ КРИСТАЛІЧНИЙ СТАН РЕЧОВИНИ Кристали – тверді тіла, в яких атоми, іони або молекули утворюють впорядковану періодичну структуру. Кристалічні гратки – просторове періодичне розташування атомів, молекул або іонів у кристалі. Кристалічний стан характеризується дальнім порядком розташування частинок, що утворюють речовину. Рідина характеризується ближнім порядком, а газовий стан характеризується повного […]...
- Розподіл молекул газу за швидкостями. Закон Максвелла ФІЗИКА Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА Розділ 4 ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ ГАЗІВ 4.7. Розподіл молекул газу за швидкостями. Закон Максвелла У рівноважному стані параметри газу залишаються незмінними, проте мікростани – взаємне розташування молекул, їхні швидкості – безперервно змінюються. Оскільки всі напрями руху рівноймовірні, розподіл молекул за напрямом буде рівномірним. Швидкості молекул становлять від нуля […]...
- ЕЛЕКТРОННА ОБОЛОНКА АТОМА Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ХІМІЧНІ ЕЛЕМЕНТИ. ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА ЕЛЕКТРОННА ОБОЛОНКА АТОМА Теорія будови електронної оболонки атома грунтується на законах квантової (хвильової) механіки. Згідно з законами квантової механіки можна говорити лише про ймовірність перебування електрона в даній точці простору навколо ядра. Модель стану електрона в атомі відповідає уявленню про […]...
- Будова електронних оболонок атомів РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 4. Будова електронних оболонок атомів Усвідомлення змісту цього параграфа дає змогу: Пояснювати значення понять “електронна оболонка атома”, “квантове число”, “електронна конфігурація атома”; характеризувати закономірності розподілу електронів у атомах; складати схеми будови атомів, електронні формули атомів хімічних елементів і електронно-графічні формули. Пригадаємо, що атом […]...
- Структурні ознаки молекул барвників КЛАСИ ОРГАНІЧНИХ РЕЧОВИН 11 . Барвники Якщо якась речовина при опроміненні видимим світлом поглинає певну частину видимого спектра (400-800 нм), то вона здається кольоровою. Людське око сприймає непоглинену, відбиту частину спектра. Ця частина є складовою падаючого світла. Запам’ятайте: кольори двох джерел світла, які разом дають біле світло, називають складовими кольорами. 11.1 . Структурні ознаки молекул […]...
- РУХ І ВЗАЄМОДІЯ АТОМІВ І МОЛЕКУЛ. ЗАЛЕЖНІСТЬ ШВИДКОСТІ РУХУ АТОМІВ І МОЛЕКУЛ ВІД ТЕМПЕРАТУРИ ТІЛА. ДИФУЗІЯ Мета: сформувати знання про безперервний хаотичний рух молекул та залежність швидкості руху від температури; сформувати експериментальні навички учнів; виховувати акуратність під час проведення експериментів, розвивати логічне мислення, вміння пояснювати фізичні явища та робити висновки з експерименту. Тип уроку: комбінований урок. Обладнання та наочність: обладнання лабораторної роботи, зошит із друкованою основою для виконання лабораторних робіт. Відеофрагмент: […]...
- ПОПУЛЯЦІЯ, ПРОСТОРОВА СТРУКТУРА Екологія – охорона природи ПОПУЛЯЦІЯ, ПРОСТОРОВА СТРУКТУРА – тип і характер розміщення особин даної популяції на території, яку вона займає. Розрізняють розподіл організмів рівномірний і нерівномірний, поодинокий і груповий тощо....