Моль. Молярна маса
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 1. ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
§ 1.6. Моль. Молярна маса
У Міжнародній системі одиниць (Сl) за одиницю кількості речовини прийнято моль.
Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься в 0,012 кг ізотопу карбону 12С.
1 Якщо до складу молекули входять атоми певного ізотопу, що завжди зазначається (наприклад, Н37 Сl), то під час обчислення відносної
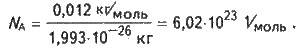
Це число називається сталою Авогадро (позначається NA, розмірність – 1 /моль), показує число структурних одиниць у молі будь-якої речовини.
Молярна маса – величина, що дорівнює відношенню маси речовини до кількості речовини.
Вона має розмірність кг/моль або г/моль; звичайно її позначають
Молярну масу речовини легко обчислити, знаючи масy молекули. Так, якщо маса молекули води дорівнює 2,99 – 10-26 кг, то молярна маса M(Н2О) = 2,99 – 10-26 кг – 6,02 – 1023 1/моль = 0,018 кг/моль, або 18 г/моль. У загальному випадку молярна маса речовини, виражена в г/моль, чисельно дорівнює відносній атомній або відносній молекулярній масі цієї речовини. Наприклад, відносні атомні й молекулярні маси С, Fe, О2, Н2О відповідно дорівнюють 12, 56, 32, 18, а їх молярні маси становлять відповідно 12 г/моль, 56 г/моль, 32 г/моль, 18 г/моль.
Молярну масу можна обчислити для речовин як у молекулярному, так і в атомарному стані. Наприклад, відносна молекулярна маса водню Mr(Н2) = 2, а відносна атомна маса Аr(Н) = 1. Кількість речовини, що визначається числом структурних одиниць (NA), в обох випадках однакова – 1 моль. Проте молярна маса молекулярного водню становить 2 г/моль, а молярна маса атомарного водню – 1 г/моль. Один моль атомів, молекул або іонів містить таке число цих частинок, що дорівнює сталій Авогадро. Наприклад:
1 моль атомів 12С = 6,02 – 1023 атомів 12С;
1 моль молекул Н2О = 6,02 – 1023 молекул Н2О;
1 моль іонів SO42- = 6,02 – 1023 іонів SO42-.
Маса і кількість речовини – поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини-в молях. Між масою речовини (m, r), кількістю речовини(n, моль) і молярною масою (М, г/моль) існують прості співвідношення:

За цими формулами легко обчислити масу певної кількості речовини, або визначити число молів речовини у відомій масі його, або знайти молярну масу речовини (див. § 1.12 – розв’язування типових задач).