Напруга розкладу – Електроліз
ОКИСНЕННЯ І ВІДНОВЛЕННЯ
4 . Електроліз
Електроліз – це зворотний процес окисно-відновної реакції, що спонтанно протікає в батареї. При використанні електричної енергії примусово викликають процес окисно-відновної реакції. Водночас електрична енергія перетворюється на хімічну енергію.
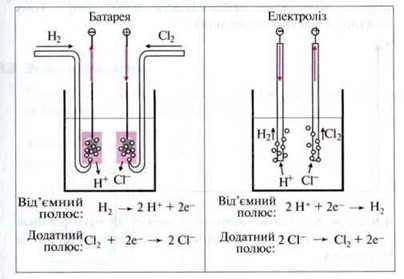
В обох випадках електрод, на якому відбувається окиснення, називають анодом (анодний протектор). Електрод, на якому відбувається відновлення, називають катодом.
У батареї анод – негативний полюс, а катод –
При електролізі анод – позитивний полюс, а катод – негативний.
4.1 . Напруга розкладу
При електролізі іони електроліту осідають на електродах і там розряджаються. Речовини, що утворюються під час процесу, осідають на електродах і разом з електролітом утворюють / гальванічний елемент, полюси якого протилежні до полюсів прикладеної напруги.
Відповідно до вольт-амперної характеристики процесу електролізу при невеликому значенні напруги струм практично не проходить, оскільки прикладена напруга і напруга поляризації нейтралізують одна одну. Тому електроліз відбуватися не може.
Лише при досягненні певного значення напруги починає проходити струм і відбувається виділення речовин на електродах.
Для проведення електролізу потрібно подолати поріг мінімальної напруги. Цю напругу називають напругою розкладу. Вона відповідає сумі окисно-відновних потенціалів, що прикладені до електродів.
Приклад. При електролізі розчину купрум(ІІ) хлориду осідає мідь і виділяється хлор.
Негативний електрод (катод): Сu2+ + 2 е – → Cu.
Позитивний електрод (анод): 2 Сl – → Сl2 + 2 е-.
Напруга розкладу U0, що потрібна для перебігу процесу електролізу, є різницею стандартних потенціалів окисно-відновних пар Cu/Cu2+ і 2 Сl-/Сl2.
U0= 1,36 В – 0,35 В = 1,01 В.
Часто для електролізу потрібна мінімальна напруга, яка суттєво перевищує розрахункову напругу розкладу. Таке перевищення напруги розкладу називають перенапругою. Її величина значною мірою визначається
– вибором матеріалу електродів;
– властивостями речовини, що осідає.
Related posts:
- Суть електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.6. Суть електролізу У розчинах і розплавах електролітів є різнойменні за знаками іони (катіони й аніони), які подібно до всіх частинок рідини перебувають у хаотичному русі. Якщо в такий розчин або розплав електроліту, наприклад у розплав […]...
- Електроліз водних розчинів електролітів – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.7. Електроліз водних розчинів електролітів Слід розрізняти електроліз розплавлених електролітів і їх розчинів. В останньому випадку в процесах можуть брати участь молекули води. Як приклад розглянемо електроліз концентрованого водного розчину хлориду натрію (електроди вугільні). В цьому […]...
- Електроліз розчинів та розплавів електролітів – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОКИСНО-ВІДНОВНІ ПРОЦЕСИ Електроліз розчинів та розплавів електролітів Сукупність ОВР, які протікають на електродах у розчинах та розплавах електролітів при пропусканні через них електричного струму, називають електролізом. На підставі етимології слова можна сказати, що електроліз (від електро… і грец. лізіс – розклад) – це […]...
- Електроліз розплавів – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах під час проходження електричного струму крізь розчин або розплав електроліту. Якщо крізь розчин електроліту пропускати постійний електричний струм, то позитивно заряджені частинки (катіони) будуть рухатися до катода […]...
- Електроліз РОЗДІЛ 3 МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ § 55. Електроліз Усвідомлення змісту цього параграфа дає змогу: Формулювати означення електролізу; Пояснювати суть електролізу розплавів і розчинів солей; Прогнозувати склад продуктів електролізу: розплавів солей, розчинів солей за активністю йонів у розчині; Складати рівняння реакцій електролізу, схеми окисно-відновних процесів на електродах; Характеризувати практичне значення електролізу. Значна кількість металів […]...
- ЕЛЕКТРОЛІЗ ВОДИ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС РЕАКЦІЇ ЗІ ЗМІНОЮ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ ЕЛЕКТРОЛІЗ ВОДИ Електроліз води – окисно-відновний процес розкладу води з утворенням водню і кисню. На катоді відбувається відновлення води з утворенням іонів ОН – і молекул Н2: На аноді здійснюється окиснення води з утворенням молекул О2 і іонів Н+: Дія електричного струму призводить […]...
- Електроліз водних розчинів електролітів (кислот, основ, солей) – Електроліз ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.13. Електроліз 6.13.2. Електроліз водних розчинів електролітів (кислот, основ, солей) Під час електролізу водних розчинів електролітів, крім катіонів і аніонів розчиненої речовини, у процесах окиснення і відновлення, що відбуваються на електродах, можуть брати участь молекули води. При цьому можуть […]...
- Загальні способи добування металів. Електроліз розплавів солей і лугів – Метали Хімія Неорганічна хімія Метали Загальні способи добування металів. Електроліз розплавів солей і лугів Металургія – це галузь промисловості, яка займається видобуванням металів із руд. Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму через розплав або розчин електроліту. Якщо в розплав електроліту, наприклад натрій хлориду, занурити інертні електроди й пропускати постійний […]...
- Застосування електролізу – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.8. Застосування електролізу Електроліз знаходить досить широке застосування. Для захисту металевих виробів від корозії на їх поверхню наносять дуже тонкий шар іншого металу – хрому, срібла, золота, міді, нікелю тощо, іноді застосовують багатошарові покриття. Наприклад, зовнішні […]...
- Роль електроліту – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Батарея складається з трьох частин: – негативний електрод, що віддає електрони при проходженні струму, тобто окислюється; – позитивний електрод, що отримує електрони при проходженні струму, тобто відновлюється; – електроліт, який має хорошу електричну провідність і тому забезпечує низький / внутрішній опір батареї. Приклад. Широко вживана батарея – лужна […]...
- Розрядження акумулятора – Акумулятори – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.4 . Акумулятори Акумулятор – це електрохімічний елемент, який після використання можна знову зарядити і, відповідно, використовувати багато разів. Щоб електрохімічний елемент можна було заряджати, продукти, що утворюються при розрядженні, не повинні розчинятися в електроліті, а залишатися на електродах. Приклад. Найпоширеніший акумулятор – свинцевий акумулятор, що використовують в автомобілях. Напруга […]...
- Закони Фарадея – Електроліз ОКИСНЕННЯ І ВІДНОВЛЕННЯ 4 . Електроліз 4.2 . Закони Фарадея Чим довше триває процес електролізу, тим більше речовини осідає на електродах. Між масою т, що осіла, і зарядом Q = І ∙ t, що проходить, існує лінійна залежність: m1 ~ Q і m2 ~ Q. Перший закон Фарадея: маси речовин, що осідають на електродах, пропорційні […]...
- Розв’язування типових задач – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.9. Розв’язування типових задач Окисно-відновні реакції Задача 1. Доберіть коефіцієнти у схемі окисно-відновної реакції: S + HNO3 −> H2SO4 + NO. Розв’язання. Коефіцієнти знаходимо методом електронного балансу. Зазначимо ступені окиснення елементів, які їх змінюють: 0 +5 […]...
- РЕАКЦІЇ РОЗКЛАДУ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ РОЗКЛАДУ З назви “реакція розкладу” також випливає, про який тип реакцій іде мова. У реакції розкладу відбувається розкладання складної речовини на декілька речовин. Продуктами реакції можуть бути як прості, так і складні речовини. Наприклад: Майже всі вказані реакції, як і переважна більшість інших реакцій розкладу, ендотермічні. Для […]...
- Внутрішній опір і термін придатності батарей – Батареї – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.3. Батареї Внутрішній опір і термін придатності батарей Батарея є електричним пристроєм і тому як будь-який інший пристрій має електричний опір, так званий внутрішній опір. Якщо до батареї підключити споживач, наприклад, лампу, то на неї подається не повна напруга джерела, а зменшена напруга на контактах (клемах). Uкл = U0 – […]...
- Найважливіші окисники і відновники – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.2. Найважливіші окисники і відновники Відновники і окисники можуть бути як простими речовинами, тобто такими, що складаються з одного елемента, так і складними. Відповідно до їх місця в періодичній системі елементів атоми більшості металів містять на […]...
- Електрична напруга 1-й семестр ЕЛЕКТРОМАГНІТНІ ЯВИЩА 2. Електричний струм Урок 7/13 Тема. Електрична напруга Мета уроку: увести поняття напруги, ознайомити учнів з одиницею напруги та навчити вимірювати напругу. Тип уроку: комбінований урок. План уроку Контроль знань 12 хв. Самостійна робота № 3 “Електричний струм. Сила струму” Демонстрації 3 хв. 1. Вольтметр. 2. Вимірювання напруги вольтметром Вивчення нового […]...
- ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ – СТРУМ В ЕЛЕКТРОЛІТАХ Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 3. ЕЛЕКТРИЧНИЙ СТРУМ У РІЗНИХ СЕРЕДОВИЩАХ 3.2. СТРУМ В ЕЛЕКТРОЛІТАХ 3.2.2. ЗАКОН ЕЛЕКТРОЛІЗУ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ Електроліз – виділення речовини на електродах при проходженні струму через електроліт. Електроліз супроводжується окисно-відновними реакціями. Закон електролізу (закон Фарадея). Маса виділеної на електроді речовини прямо пропорційна заряду, що пройшов через електроліт: Тут k […]...
- Класифікація окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.5. Класифікація окисно-відновних реакцій Звичайно розрізняють три типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні і реакції диспропорціонування. До міжмолекулярних належать реакції, у яких окисник і відновник входять до складу різних речовин. Розглянуті в §7.3 І 7.4 реакції належать […]...
- ЕЛЕКТРИЧНА НАПРУГА Фізика підготовка до ЗНО комплексне видання ЕЛЕКТРОДИНАМІКА 1. ОСНОВИ ЕЛЕКТРОСТАТИКИ 1.6. ЕЛЕКТРИЧНА НАПРУГА Сторонні сили – це будь-які сили, крім кулонівських, які діють на заряд Напруга – це величина, яка чисельно дорівнює роботі всіх (кулонівських і сторонніх) сил при перенесенні одиничного позитивного заряду через дану ділянку: Якщо діють тільки кулонівські сили, то Робота на переміщення […]...
- Теорія окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.1. Теорія окисно-відновних реакцій Усі хімічні реакції можна розділити на два типи. До першого належать реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин. Наприклад: +1 +5 -2 +1 -2 +1 […]...
- Електрохімічний ряд напруг металів – Електрохімія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 3. Електрохімія 3.2. Електрохімічний ряд напруг металів Щоб використовувати окисно-відновну реакцію, яка проходить між металом і іонами менш активного металу, для отримання електричної енергії, також потрібно провести просторове розділення “партнерів” окисно-відновної реакції. Приклад. Якщо пластинку заліза помістити в розчин, що містить іони Феруму, а мідну пластинку в розчин, який містить іони Купруму, […]...
- СИЛИ ПРУЖНОСТІ. ЗАКОН ГУКА. МЕХАНІЧНА НАПРУГА – СИЛИ В МЕХАНІЦІ Фізика підготовка до ЗНО комплексне видання МЕХАНІКА 2. ОСНОВИ ДИНАМІКИ 2.2. СИЛИ В МЕХАНІЦІ 2.2.2. СИЛИ ПРУЖНОСТІ. ЗАКОН ГУКА. МЕХАНІЧНА НАПРУГА Сили пружності – це сили, які виникають при деформації тіла і перешкоджають цій деформації. Сили пружності спрямовані перпендикулярно до поверхні деформованого тіла () – наприклад, нормальна реакція опори (сила пружності підставки), або вздовж нитки […]...
- Реакції термічного розкладу деяких солей ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання ДОДАТКИ Додаток 14. Реакції термічного розкладу деяких солей Хлориди, йодиди Хлорати Нітрати, нітрити Фосфати, Гідрогенфосфати, Дигідрогенфосфати Карбонати, Гідрогенкарбонати Сульфати Сульфіти Солі амонію Інші солі...
- Вплив середовища на характер перебігу реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ § 7.4. Вплив середовища на характер перебігу реакцій Реакції окиснення – відновлення можуть відбуватися в різних середовищах: у кислому (надлишок Н+-іонів), нейтральному (Н2О) і лужному (надлишок гідроксид-іонів ОН – ). Залежно від середовища може змінюватись і характер […]...
- Добування кисню. Реакція розкладу Тема 2 Кисень & 17. Добування кисню. Реакція розкладу Опанувавши цю тему, ви зможете: – знати реакції, які взято за основу добування кисню в лабораторії та промисловості, способи збирання кисню і реакції розкладу; – складати рівняння реакцій добування кисню; – формулювати визначення реакції розкладу, каталізатора і розуміти їхню суть; – досліджувати наявність кисню; – формувати […]...
- ДОБУВАННЯ ТА ЗБИРАННЯ КИСНЮ. ПОНЯТТЯ ПРО КАТАЛІЗАТОРИ. РЕАКЦІЯ РОЗКЛАДУ № 1. Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять до складу утворених продуктів реакції. Тому їхні формули не пишуть ні в лівій, ні в правій частині рівнянь хімічних реакцій. Кисень добувають з розчину гідроген пероксиду Н2O2. Для прискорення реакції додають невелику кількість манган (IV) […]...
- ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ “ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ. ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ” Інтегрований урок з фізики й хімії Мета. Дати учням уявлення про електроліз як окисно-відновний процес; розвивати вміння спостерігати, аналізувати фізичні й хімічні явища, робити висновки; закріпити поняття “електролітична дисоціація”, “окисно-відновні реакції”, показати єдність законів фізики і хімії. Тип уроку. Урок вивчення нового матеріалу. Обладнання. Таблиця “Електроліз солей”, чеканка, позолочені […]...
- Реакції сполучення, розкладу, заміщення й обміну Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 22 Тема уроку. Реакції сполучення, розкладу, заміщення й обміну Цілі уроку: розвивати навички й уміння складати рівняння хімічних реакцій; формувати навички розпізнавання типів реакцій теоретично – за рівняннями реакції, експериментально – за ознаками хімічних реакцій. Тип уроку: формування вмінь і навичок. Форми роботи: фронтальне опитування, демонстраційний експеримент, групова робота, самостійна […]...
- Модель Томсона БУДОВА АТОМА 2. Модель Томсона Досліди Майкла Фарадея з електролізу в 1833 році та відкриття електрона Дж. Дж. Стоні в 1881 році вже неможливо було пояснити простою моделлю Дальтона. Дж. Дж. Томсон у 1904 році запропонував модель атома, що включала поняття заряду. – Атом складається з кулі, що має позитивний електричний заряд, в якій розміщені […]...