Окисно-відновні реакції – ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОКИСНО-ВІДНОВНІ ПРОЦЕСИ
Окисно-відновні реакції
За зміною ступенів окиснення елементів, що входять до складу реагентів та продуктів реакції, усі хімічні реакції можна розділити на дві групи, а саме на:
1) Реакції, що протікають без зміни ступенів окиснення всіх елементів. До таких реакцій належать, зокрема, реакції іонного обміну в розчинах та деякі інші:
AgNO3 + NaCl → AgCl ↓ і + NaNO3.
2) Реакції, що протікають зі зміною ступеня окиснення всіх
– усі елементи змінюють ступені окиснення:
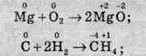
– деякі елементи змінюють ступені окиснення:
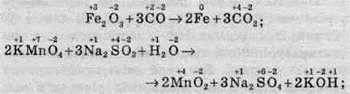
– один елемент змінює ступінь окиснення:
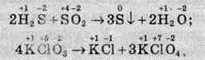
Хімічні реакції, які протікають зі зміною ступеня окиснення елементів, що входять до складу реагентів, називають окисно-відновними реакціями (ОВР).
Будь-який окисно-відновний процес обов’язково складається з двох протилежних процесів – окиснення та відновлення.
Окиснення – це процес віддачі електронів атомом,
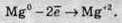
Якщо негативно заряджена частинка віддає електрон, то вона може перетворюватися в нейтральний атом або позитивно заряджену частинку:
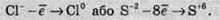
Якщо ж позитивно заряджена частинка віддає електрони, то вона збільшує свій позитивний заряд:
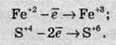
Відновлення – це процес прийому електронів атомом, іоном або молекулою. Якщо нейтральний атом приймає електрони, то він перетворюється в негативно заряджену частинку:
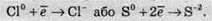
Якщо позитивно заряджена частинка приймає електрони, то вона зменшує свій позитивний заряд і залежно від числа прийнятих електронів може перетворитися в позитивно заряджену частинку з меншим позитивним зарядом, нейтральний атом або негативно заряджену частинку:
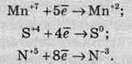
Частинку (атом, молекулу або іон), яка приймає електрон, називають окисником, а частинку, яка віддає електрони – відновником. Окисник у процесі реакції відновлюється, а відновник – окислюється. Оскільки в результаті реакції одна частинка віддає електрони, то обов’язково має бути частинка, яка ці електрони приймає, тому процеси окиснення й відновлення нерозривно пов’язані й не можуть протікати незалежно один від одного. Із цієї ж точки зору в окисно-відновному процесі обов’язково мають брати участь окисник і відновник, ОВР не може протікати між двома окисниками або між двома відновниками.
При складанні окисно-відновних процесів також необхідно пам’ятати про правила зазначення заряду частинок. Якщо зазначається заряд реально існуючого іона, що, наприклад, утворюється при дисоціації у воді, то спочатку зазначають величину заряду, а вже потім його знак. Якщо ж заряд зазначається для якого-небудь “гіпотетичного” іона, що в реальних системах не існує, а входить тільки до складу більш складних частинок, то спочатку вказують знак заряду, а вже потім його величину, тобто в цьому разі вказують ступінь окиснення елемента. Наприклад, при дисоціації натрій сульфату у воді утворюються іони Натрію із зарядом +1 і сульфат-іони із зарядом -2. У цьому разі частинки реально існують у розчинах, тому їх позначають як Na+ (Na1+) і SO42-. Але до складу сульфат-іона входять атоми Сульфуру зі ступенем окиснення +6 і атоми Оксигену зі ступенем окиснення -2. Ці частинки не існують окремо, а тільки в складі більш складного іона, тому їх можна назвати “гіпотетичними” іонами й, окрім того, через те, що між цими атомами зв’язок не іонний, а ковалентний, реальні заряди на цих атомах не дорівнюють відповідно +6 і -2, але для складання ОВР це не має значення, й указують ступені окиснення атомів. Тому ці частинки позначають так: S+6 та О-2.