Охорона навколишнього середовища в металургійному виробництві й використанні металів. Значення неорганічних сполук у природі, техніці й житті
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 33
Тема уроку. Охорона навколишнього середовища в металургійному виробництві й використанні металів. Значення неорганічних сполук у природі, техніці й житті
Цілі уроку: узагальнити й систематизувати знання учнів про метали, їх будову, властивості, способи одержання; розвивати вміння й навички складання ОВР, іонних рівнянь, розв’язання задач за рівнянням реакції; формувати уявлення про принципи захисту навколишнього середовища в металургійному виробництві,
Тип уроку: узагальнення й систематизації отриманих знань.
Форми роботи: семінар, фронтальна робота, групова робота.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності, ряд активності металів.
ХІД УРОКУ
I. Організація класу
II. Аналіз практичної роботи № 2, коригування знань, обговорення типових помилок
ІІІ. Вивчення нового матеріалу
Семінар
Учні об’єднуються в групи для роботи над питаннями. Завдання
Групи 1, 5
1. Регенерацію олова з консервних бляшанок з наступним електролізом натрій станату можна описати рівнянням:
Sn + 2NaOH + O2 = Na2SnO3 + H2O
Обчисліть об’єм розчину натрій гідроксиду (? = 1,44 г/мл) з масовою часткою NaOH 40 %, потрібний для розчинення всього олова, що міститься в 100 консервних бляшанках. Маса олова в кожній бляшанці становить 0,4 г.
2. Здійсніть перетворення:
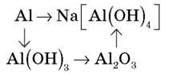
3. Захист навколишнього середовища під час виробництва чавуну та сталі.
Групи 2, 6
1. Прожарюванням гіпсу CaSО4 – 2H2О за температури 280 °С одержують алебастр (СaSО4)2 – H2О, що застосовується як добавка під час виготовлення штукатурки для стін і стель. яка маса гіпсу, що містить 2 % піску, витрачається на одержання алебастру масою 15 кг? Чому в процесі одержання алебастру не можна піднімати температуру вище від 180 °С?
2. Здійсніть перетворення:
Fe  FeSО4
FeSО4  Fe2(SО4)3
Fe2(SО4)3  Fe(ОH)3
Fe(ОH)3  Fe(NO3)3
Fe(NO3)3
3. Захист навколишнього середовища в кольоровій металургії.
Групи 3, 7
1. У процесі одержання золота з руд ціанідним способом подрібнену руду бідних порід обробляють слабким розчином (0,03-0,2 %) натрій ціаніду. Золото переходить у розчин, утворюючи комплексну сполуку Ауруму(І):
О2 + 4Au + 8NaCN + 2H2О = 4Na[Au(CN)2] + 4NaОH
З розчину золото виділяють металевим цинком:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Обчисліть масу розчину натрій ціаніду з масовою часткою 0,2 % і масу цинку, необхідні для одержання 112 г золота.
2. Здійсніть перетворення:
CaCО3  A
A  Ca(ОH)2
Ca(ОH)2  Ca(NО3)2
Ca(NО3)2  Б
Б  CaCl2
CaCl2
3. Раціональне використання природних ресурсів. Охорона навколишнього середовища в процесі використання металів.
Групи 4, 8
1. Один з напрямів розвитку металургії – порошкова металургія. Титан у вигляді дрібного порошку одержують шляхом відновлення титан(IV) оксиду кальцій гідридом у процесі нагрівання у вакуумі:
TiO2 + CaH2 = Ti + Ca(OH)2
Обчисліть масу титану, яку можна одержати з титанової руди масою 80 кг, якщо масова частка TiO2 в ній становить 93 %, а масова частка виходу – 90 %.
2. Здійсніть перетворення:
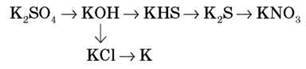
3. Значення неорганічних сполук у природі, техніці, житті.
Учні готують відповіді на запитання й задачі. Завдання в групах дублюються з метою взаємоперевірки та взаємоконтролю.
Відповіді на третє питання групи дають у класі. Учні обговорюють, доповнюють відповіді. Учитель узагальнює відповіді учнів, за необхідності доповнює їх.
IV. Підбиття підсумків уроку
V. Домашнє завдання
Підготуватися до контрольної роботи з теми “Метали”.