Перший принцип термодинаміки
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 7 ОСНОВИ ТЕРМОДИНАМІКИ
7.4. Перший принцип термодинаміки
Перший принцип термодинаміки є узагальнювальним законом збереження і перетворення енергії, сформульованим щодо процесів, у яких бере участь теплота.
Перший принцип термодинаміки можна сформулювати так: надана системі теплота витрачається на збільшення її внутрішньої енергії, а також на роботу проти зовнішніх сил.
Цим принципом було підведено підсумок численним експериментам щодо створення “вічного
Тому не дивно, що було надто багато спроб побудувати такий вічний двигун. Проте це нікому не вдалось. Відповідь на запитання “чому” дає перший принцип термодинаміки. З філософського погляду це формулювання першого принципу термодинаміки, а отже, і закону збереження енергії менш задовільне, ніж попереднє, бо воно заперечне. Всяке твердження, подане в заперечній формі, має меншу пізнавальну та наукову цінність, ніж твердження, подане у стверджувальній формі. У заперечній формі закону збереження енергії криється його конкретний, реальний зміст як універсального і абсолютного закону природи. Найголовніше в законі збереження г. перетворення енергії – це перетворюваність форм руху матерії з однієї в іншу. Проте в заперечному формулюванні закон збереження енергії зводиться до простого констатування про неможливість сконструювати машину, яка б працювала, не витрачаючи енергії. Цим обмеженим змістом закону збереження енергії в зазначеній заперечній формі користувались махісти у своїй боротьбі проти матеріалізму. Е. Мах, наприклад, намагався довести, що закон про неможливість створення вічного двигуна першого роду тотожний закону причинності. Отже, він не бачив нічого нового в законі збереження енергії, крім простого констатування причинного зв’язку між явищами. Саму причинність Е. Мах розумів ідеалістично, як обмеженість нашого суб’єктивного очікування, а не закон природи. Розглянемо термодинамічну систему, повна енергія якої

Де Еп – потенціальна енергія системи; Ек – кінетична енергія системи; U – її внутрішня енергія. Припустімо, що взаємодії системи із зовнішнім середовищем немає, тоді Еп = 0. Якщо система нерухома відносно зовнішніх тіл, то і Ек = 0.
Внутрішня енергія системи складається з кінетичної і потенціальної енергій складових її елементів:

Припустімо, що в системі відбувається довільний коловий процес, коли система, зазнавши змін, повертається до самого початкового стану, як це схематично зображено на рис. 7.4. Чи зміниться енергія системи в стані В після колового процесу ВаСbВ? На підставі багатовікового досвіду, узагальненого в законі збереження й перетворення енергії, можна відповісти на це запитання так: внутрішня енергія системи в певному стані є величиною сталою і не залежить від того, як саме система прийшла до цього стану.
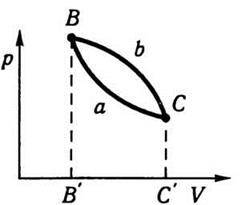
Рис. 7.4
Якщо система, переходячи із стану В у стан С, унаслідок взаємодії з середовищем дістане енергію U1, а потім, повертаючись до стану В, віддасть середовищу енергію U2, то ці енергії дорівнюватимуть одна одній: U1 = U2. Інакше виходило б, якби енергія виникала з нічого або зникала безслідно, це суперечило б закону збереження й перетворення енергії. Звідси випливає важливий висновок: внутрішня енергія термодинамічної системи є однозначною функцією стану, тобто кожному стану відповідає певне значення внутрішньої енергії. Зрозуміло, що обернене твердження – кожному значенню внутрішньої енергії відповідає певний стан – цілком неправильне, бо певному значенню внутрішньої енергії можуть відповідати різні стани. Енергія є мірою руху. Рух є невід’ємною властивістю матерії. Тому збільшення чи зменшення енергії системи означає зміну в ній руху в кількісному та якісному відношеннях. Зміна руху супроводжується зміною властивостей системи, її фізичного стану, який характеризується певними параметрами. Припущення, що в тому самому стані системи енергія може бути неоднаковою за значенням, рівнозначне припущенню, що рух не зв’язаний з матерією, а є чимось зовнішнім відносно неї. Проте це суперечить основам матеріалістичної діалектики про нерозривний зв’язок матерії й руху. Внутрішня енергія – однозначна функція термодинамічного стану. Внутрішня енергія системи в станах В і С (див. рис. 7.4) визначається станами системи і не залежить від того, як саме система перейшла, наприклад, зі стану В у С (ВаС чи ВbС). Отже, зміна внутрішньої енергії системи при переході з одного стану в інший не залежить від способу (шляху) переходу; вона залежить тільки від початкового й кінцевого станів. Це є ще одним формулюванням першого принципу термодинаміки.
Перейдемо до кількісного формулювання його. Розглянемо термодинамічну систему, наприклад газ у циліндрі з поршнем, що переміщується. Внаслідок взаємодії з середовищем енергія переходить до системи або, навпаки, від системи до середовища. Обмін енергією може здійснюватися тільки двома способами: в результаті роботи або нагрівання. Ці два способи не виключають один одного і можуть діяти одночасно: наприклад, енергію газу можна збільшити одночасним стисканням і нагріванням. Якщо тіло не одержує ззовні ніякої енергії, то робота, що її виконує газ при своєму розширенні, виконується за рахунок його внутрішньої енергії. Ця енергія U складається з кінетичної енергії теплового руху молекул та потенціальної енергії взаємодії їх.
Проте зміна внутрішньої енергії тіла при довільному процесі, взагалі кажучи, не збігається з виконаною роботою, бо тіло може одержувати (або віддавати) енергію також через безпосередній перехід від інших тіл. При цьому механічна робота не виконується. Одержану таким чином енергію називають кількістю теплоти. Вважатимемо цю величину додатною, якщо тіло дістає деяку кількість теплоти, і від’ємною, якщо воно віддає її.
Нехай газу під поршнем надали кількість теплоти ΔQ = Q2 – Q1. Внаслідок розширення газу поршень підніметься на висоту Δh. Якщо тиск над поршнем залишається сталим (р = const), то робота, яку виконує газ, визначається формулою

Проте ΔQ ≠ ΔА, оскільки частина підведеної до системи теплоти перетворюється у внутрішню енергію газу ДС/. Тоді справедлива така рівність:

Де ΔQ – одержана кількість теплоти; ΔА – робота, що виконується; ΔU – зміна внутрішньої енергії системи при переведенні її під час нагрівання з одного стану в інший. Співвідношення (7.9) є кількісним виразом закону збереження енергії при теплових процесах, тобто є першим принципом термодинаміки, який можна сформулювати так: кількість теплоти, надана системі, витрачається на приріст внутрішньої енергії та на виконання системою роботи над зовнішніми тілами.
Повернімося до рис. 7.4. Нехай система при нагріванні переходить зі стану В у стан С спочатку шляхом ВаС, а потім – шляхом ВbС. Робота, яку виконає система при цьому, визначатиметься площею, охопленою кривою ВаС, ординатами ВВ’ і СС’ та віссю об’ємів у першому випадку, і площею, охопленою кривою ВЬС, ординатами ВВ’ і СС’ і віссю об’ємів – у другому випадку. З рис. 7.4 видно, що ці площі різні: при переході зі стану В у стан С шляхом ВаС система виконує більшу роботу, ніж при переході шляхом ВbС. Отже, робота, яку виконує система при переході з одного стану в інший, залежить від шляху переходу. Оскільки ΔU у рівнянні (7.9) є величиною сталою для даних початкового й кінцевого станів, а кількість виконуваної роботи не є величиною сталою і залежить від шляху, то очевидно, що кількість теплоти, яку треба видати системі, щоб перехід відбувся, також залежить від шляху переходу. Як випливає з (7.9), для переходу зі стану В у стан С шляхом ВаС система має дістати більшу кількість теплоти, ніж для переходу шляхом ВbС.
Отже, як робота, виконана системою, так і кількість теплоти, яку дістає система при переході з одного стану в інший, залежать від шляху переходу.
Цілком зрозуміло, що наведені міркування залишаються в силі і тоді, коли система при переході віддає теплоту або коли над системою виконується робота.
Таким чином, коли відомі тільки початковий і кінцевий стани системи, а шлях, яким відбувся перехід, невідомий, то не можна нічого сказати про те, скільки енергії система дістала (або втратила) в результаті роботи і скільки від нагрівання: кількість роботи й кількість теплоти не є функціями стану термодинамічної системи. Отже, зміст першого принципу термодинаміки можна розкрити за допомогою внутрішньої енергії системи і двох єдино можливих еквівалентних форм передавання енергії – роботи й теплоти.