ПОЧАТКОВІ ВІДОМОСТІ ПРО БУДОВУ РЕЧОВИНИ. АТОМИ І МОЛЕКУЛИ
Розділ 1 ФІЗИКА ЯК ПРИРОДНИЧА НАУКА
МЕТОДИ НАУКОВОГО ПІЗНАННЯ
& 5. ПОЧАТКОВІ ВІДОМОСТІ ПРО БУДОВУ РЕЧОВИНИ. АТОМИ І МОЛЕКУЛИ
Виникає питання: з чого ж складається речовина? Протягом тисяч років учені задумувалися над цим питанням. Понад 2500 років тому давньогрецький учений Демокріт зробив припущення, що всі речовини складаються з найдрібніших частинок – атомів (від грец. атом – неподільний), які вже неможливо поділити на менші частинки.
Уперше побачити окремі атоми вченим вдалося лише у другій половині XX ст. за допомогою
У різних речовин атоми також різні. Вже відкрито понад сто різних атомів, які називають хімічними елементами. Щоб розрізняти
Молекули. Уявіть, що ви в шкільній залі, де відбувається бал.
Заграла музика. І от спочатку одна, дві, а потім усе більше й більше пар кружляють у танку. Кожна пара – маленьке об’єднання, але кожна пара танцює сама по собі. Щось подібне відбувається і в світі атомів.
Окремі атоми можуть об’єднуватися між собою. Об’єднання з двох, трьох або більшої кількості однакових або різних атомів утворюють молекули (від лат. молекула – маленька маса).

Мал. 1.17
Мал. 1.18
Важко уявити розміри і кількість молекул, з яких складаються ті або інші тіла. Чому? Самі поміркуйте. У краплині води міститься 1500 000 000 000 000 000 000 молекул води! Якщо вишикувати в ланцюжок усі ці молекули, то довжина ланцюжка дорівнюватиме відстані від Землі до Сонця. Якщо збільшити, наприклад, молекулу до розмірів яблука та у стільки само разів яблуко, то воно стане завбільшки із Землю.
Відмінність атомів і їх здатність об’єднуватися в молекули – одна з причин того, що різні речовини мають неоднакові властивості. Кисень підтримує процес горіння, а азот – ні. Вода за кімнатної температури – прозора рідина, а залізо – сріблясте тверде тіло.
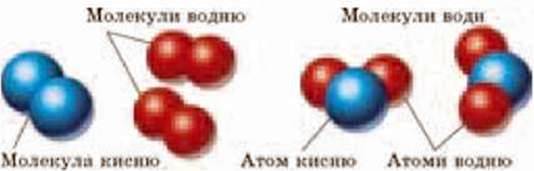
Речовини, молекули яких складаються з атомів одного й того ж самого елемента, називаються простими речовинами. Молекули кисню складаються з двох атомів Оксигену. Кисень – проста речовина. Молекулу води позначають H2O. Неважко здогадатися, що вона складається з двох атомів Гідрогену та одного атома Оксигену. Вода – складна речовина. На мал. 1.18 зображено моделі цих молекул.
Є й такі елементи, атоми яких не об’єднуються ні між собою, ні з атомами інших елементів. Молекули таких речовин складаються лише з одного атома, тобто є одноатомними.
Внутрішню будову атома уявити важко. Однак процеси, які відбуваються в атомах, відіграють надзвичайно важливу роль у Всесвіті. Саме завдяки їм зірки випромінюють світло й тепло. Пізнання будови атомів дало змогу створити нові джерела енергії, винайти нові засоби зв’язку, отримати матеріали, яких немає в природних умовах. Вогні неонових реклам, світіння електричної лампочки у вашій квартирі – це також наслідки тих процесів, які відбуваються в атомах.
Початкові відомості про будову атома. У XIX ст. більшість учених визнавали існування атомів як найдрібніших частинок, з яких побудована речовина. Проте в кінці XIX ст. було відкрито частинку, яка виявилася в 1840 разів легшою від найлегшого за відомих у природі атома – Гідрогену. Цю частинку назвали електрон. Його було так названо за притаманну йому властивість, якої набуває потертий об хутро бурштин. Грецька назва бурштину “електрон”, що означає “сонячний камінь”.
За легендою, першим дослідив властивість виробів з бурштину, потертих об вовну, притягувати до себе легкі предмети знаменитий стародавній філософ Фалес Мілетський. Пізніше виявили, що подібних властивостей набувають тіла, виготовлені й з інших речовин: скло, потерте об шовк, ебоніт, потертий об хутро, пластмасові предмети, потерті папером, й ін. Цю властивість назвали електричний заряд.
Вивчаючи електричні заряди, яких набували різні тіла, вчені виявили, що електричний заряд бурштину, натертого вовною, дещо інший, ніж заряд, якого набуває потерте об шовк скло. Так, дві бурштинові палички після натирання вовною відштовхуються одна від одної. Скляні палички, натерті шовком, теж відштовхуються. А натерті шовком скляна й вовною бурштинова палички притягуватимуться. На підставі цього дійшли висновку, що існує два типи електричних зарядів. Тіла, які мають заряди одного типу, відштовхуються, а тіла з різними зарядами – притягуються. Заряд, що виникає на бурштині, натертому вовною, й такий самий заряд на тілах з інших речовин, назвали негативними і позначили “-“. Заряд скляної палички, потертої об шовк, назвали позитивним і позначили “+”.
Результати дослідів, проведених англійським фізиком Джозефом Томсоном та американським ученим Робертом Міллікеном, свідчили, що електрон має найменший негативний електричний заряд, який далі не ділиться. Відкриття електрона показало, що атом не є чимось на зразок суцільної кульки, а має складну будову.
Подальші дослідження будови атома довели, що він складається з позитивно зарядженого масивного ядра та електронної оболонки. Його розміри визначаються діаметром електронної оболонки. Діаметри ядер у тисячу разів менші, ніж розміри атомів. Кількість електронів у атомі така, що їх загальний (негативний) заряд дорівнює позитивному заряду ядра, тому атом у звичайному стані нейтральний (не має електричного заряду).
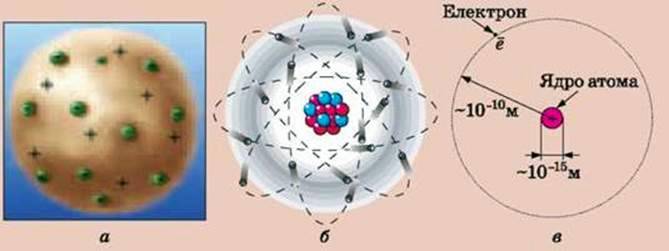
Першу модель внутрішньої будови атома запропонував Дж. Томсон. За цією моделлю атом – це суцільна куля радіусом у стомільйонну частину сантиметра (108 см) з позитивним зарядом. У цю кулю вкраплені, ніби родзинки у пудинг, електрони (мал. 1.19, а). Сумарний заряд електронів і позитивний заряд кулі однакові. Тому загалом атом нейтральний. Таке уявлення про будову атома дістало назву пудингової моделі атома, або моделі атома Томсона.
Мал. 1.19
Дослідження, проведені на початку XX ст. видатним англійським фізиком Ернестом Резерфордом та іншими вченими, дали змогу встановити, що пудингова модель не відповідає дійсності. Результати виконаних ними експериментів показали, що атом має дуже мале за розмірами, але дуже масивне позитивно заряджене ядро. Було запропоновано іншу модель: атом нагадує Сонячну систему – навколо маленького масивного, позитивно зарядженого ядра обертаються електрони, ніби планети навколо Сонця. Цю модель назвали планетарною, або моделлю атома Резерфорда.
Атоми часто зображають у вигляді, що нагадує планетну систему (мал. 1.19, б, в). Насправді це дуже наближена модель будови атома, за допомогою якої можна пояснити лише деякі його властивості.
У XX ст. було виявлено, що ядро атома також не суцільне. Воно складається з протонів – позитивно заряджених частинок і нейтронів – частинок, які не мають електричного заряду. У протона заряд такий самий, як і в електрона, але він більш як у 1840 разів масивніший. Маса нейронів дещо більша, ніж протонів. У нейтральному атомі кількість електронів дорівнює кількості протонів. Найлегшим і найпростішим за своєю будовою виявився атом водню (Гідрогену). Його ядро складається лише з одного протона, а оболонка – з одного електрона.
Електромагнітні поля, породжені зарядженими частинками, що входять до складу атома, утримують його електронну оболонку. Завдяки електромагнітним полям атоми можуть взаємодіяти між собою й з’єднуватися в молекули. Протони і нейтрони утримуються в ядрі за рахунок особливого поля, яке забезпечує їх сильну взаємодію. За звичайних умов, оскільки кількість протонів і електронів у атомів однакова, сумарний позитивний і негативний заряди атомів і відповідно тіл дорівнюють нулю.
Атоми можуть втрачати один або кілька своїх електронів і включати до своїх оболонок електрони інших атомів. Такі атоми називають іонами. Атом, що втратив електрон, стає позитивним іоном. Позитивний заряд його ядра буде більшим за загальний заряд електронної оболонки. Навпаки, якщо атом приєднує до себе електрон, він стає негативно зарядженим іоном. Електрони різних речовин по-різному пов’язані з ядрами атомів. Коли паличку зі скла натирають шовком, частина електронів його атомів переходять до шовку. Ці атоми стають позитивними іонами. Тому скляна паличка набуває позитивного заряду.
ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Які є свідчення того, що речовина складається з атомів і молекул?
2. Чи насправді атом є неподільним?
3. Наведіть приклади атомів та приклади молекул різних речовин.
4. Чому різні речовини мають неоднакові властивості?
5. Маса молекули води становить 0,000 000 000 000 000 000 000 027 (2,7 ∙ 10-23 г). Знаючи масу молекули, знайдіть їх кількість у 1 г води.
6. Фізики жартують! Отримати частинку розмірами з атом виявляється не так уже й складно. Спробуйте! Для цього візьміть велике яблуко, розріжте його навпіл. Одну з половинок знову розріжте навпіл. Повторіть цю процедуру ще 30 разів і ви досягнете мети. У ваших руках буде один з атомів яблука.