Поняття про сплави. Корозія металів. Захист від корозії
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 27
Тема уроку. Поняття про сплави. Корозія металів. Захист від корозії
Цілі уроку: ознайомити учнів з поняттям “сплави”, їхнім складом, властивостями, процесом руйнування металів під дією навколишнього середовища, основними способами захисту металів від корозії; продовжити формування вмінь і навичок складання рівнянь окисно-відновних реакцій на прикладі хімічної корозії.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування
Форми роботи: семінар, фронтальна робота.
Обладнання: періодична таблиця хімічних елементів Д. І. Менделєєва, ряд активності металів, таблиці “Сплави” та “Корозія”, колекція “Сплави”.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
1. Заслуховування та розв’язання задач, складених учнями
2. Розгляд колекції сплавів
Розповідь учителя
Сплави – це матеріали, що мають металічні властивості та складаються з двох або більше хімічних елементів, з яких хоча б один є металом. Багато металевих сплавів
Майже всі метали, що мають промислове значення, використовуються у формі сплавів. Так, усе виплавлюване залізо майже цілком використовується для виготовлення звичайних і легованих сталей, а також чавунів. Сплавленням з деякими компонентами можна істотно поліпшити властивості багатьох металів. Якщо для чистого алюмінію межа текучості становить лише 35 МПа, то для алюмінію, що містить 1,6 % міді, 2,5 % магнію та 5,6 % цинку, вона може перевищувати 500 МПа. Аналогічно можна поліпшити електричні, магнітні й термічні властивості. Ці поліпшення визначаються структурою сплаву – розподілом і структурою його кристалів і типом зв’язків між атомами в кристалах.
Багато металів, наприклад магній, виробляють високочистими, щоб можна було точно знати склад сплавів, які виготовляються з нього. Кількість металевих сплавів, застосовуваних сьогодні, дуже велика й безупинно зростає. їх прийнято поділяти на дві великі категорії: сплави на основі заліза та сплави кольорових металів. У таблиці наводяться найважливіші сплави промислового значення та вказуються основні галузі їх застосування.
Доповіді учнів про основні сплави
Орієнтовний перелік тем для обговорення
– Сталь.
– Чавун.
– Сплави на основі міді.
– Свинцеві сплави.
– Легкі сплави:
¦ алюмінієві сплави;
¦ магнієві сплави;
¦ титанові сплави;
¦ берилієві сплави.
– Амальгами.
– Золоті сплави.
– Тверді сплави.
– Друкарські сплави (гарт).
– Цинкові сплави.
IІІ. Корозія металів, способи захисту від корозії
Металеві конструкції широко використовуються в житті й діяльності людини. Близько 2 % залізних виробів щодня руйнуються через іржавіння заліза. У перерахуванні на кількість конструкцій це приблизно 3-5 млн. м3 залізобетонних конструкцій.
– Чому руйнуються металеві конструкції?
– Що необхідно зробити, щоби призупинити цей процес?
Розберемося в сутності цього процесу та знайдемо його причини.
1. Корозія – це хімічне або електрохімічне руйнування металів під дією навколишнього середовища.
Хімічна корозія – це процес руйнування металів під дією агресивного середовища (газу або рідини).
Відбувається мимовільно в рідинах:
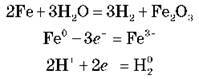
У процесі контакту з агресивним газом:
2Fe + 3Cl2 = 2FeCl3
В атмосфері кисню:
NMe + (n/2)O2 = Me2On
Окиснення у вологому повітрі:
2Fe + 2H2O + O2 = 2Fe(OH)2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Учні записують ОВР самостійно в зошитах або на дошці.
Електрохімічна корозія – це процес, що протікає за наявності двох-трьох металів у середовищах з іонною провідністю. На аноді (більш активному металі) відбувається окиснення цього металу; на катоді (менш активному металі) – відновлення водню.
Наприклад, для пари Zn – Cu в агресивному середовищі виникає процес:
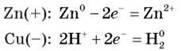
У цьому випадку активний метал швидко руйнується. Демонструємо медіа-фрагмент (або плакат) про корозію.
2. Учитель пропонує учням назвати способи захисту металів від корозії, записує їх на дошці, доповнює й коментує не названі способи захисту:
– Застосування захисних покриттів:
¦ нікелювання, хромування;
¦ лаки, фарби, емалі;
¦ захисні оксидні плівки (оксидування (Al2О3, Fe3О4));
¦ фосфатні покриття (ZnHPО4 + H3PО4).
– Сплави, стійкі до корозії (легування хромом Сг, нікелем Ni, вольфрамом W та ін.).
– Електрохімічні методи:
¦ заклепки з більш активного металу;
¦ пластини з більш активного металу;
¦ нейтралізація струму в разі корозії постійним струмом у протилежному напрямку.
– Зміна складу середовища, використання інгібіторів.
IV. Застосування отриманих знань
Групові завдання
Завдання в групах повторюються з метою взаємоперевірки та взаємоконтролю.
Група 1
1. На сталевій кришці поставлено мідну заклепку. Що зруйнується раніше – кришка чи заклепка? Чому?
2. Зразок сплаву магнію з міддю масою 27 г обробили надлишком розчину хлоридної кислоти. Виділився газ об’ємом 16,8 л (н. у.). Обчисліть масову частку міді в сплаві. (33,3 %)
Група 2
1. Чому луджений (покритим оловом) залізний бак на місці ушкодження швидко руйнується?
2. Зразок латуні (Cu + Zn) масою 200 г з масовою часткою міді 60 % обробили надлишком хлоридної кислоти. Обчисліть об’єм газу, що виділився (н. у.). (27,57 л)
Група 3
1. Який метал унаслідок взаємного контакту в присутності електроліту зруйнується швидше – алюміній чи залізо? Чому?
2. Зразок сплаву заліза з вуглецем масою 5 г розчинили в надлишку хлоридної кислоти. Після завершення реакції об’єм водню, що виділився (н. у.), становив 1,96 л. Обчисліть масову частку заліза в сплаві. (98 %)
Група 4
1. Чому на оцинкованому цебрі на місці подряпини цинк руйнується, а залізо не іржавіє?
2. Сталевий дріт масою 6 г спалили в кисні. При цьому утворився 0,1 г карбон(^) оксиду. Обчисліть масову частку вуглецю в сталі. (0,45 %)
V. Підбиття підсумків уроку
Групи, які виконали завдання першими, відповідають біля дошки, розв’язання обговорюється в класі, колегіально оцінюється робота учнів.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання.
Випереджальні завдання
1. Положення Натрію й Калію в періодичній системі. Будова їхніх атомів. Фізичні властивості натрію й калію.
2. Поширення Натрію й Калію в природі. Способи їх одержання.
3. Хімічні властивості Натрію й Калію.
4. Оксиди Натрію й Калію, їх властивості, застосування.
5. Гідроксиди Натрію й Калію, їх властивості, застосування.
6. Солі Натрію й Калію. Калійні добрива.