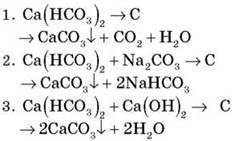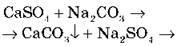ПОНЯТТЯ ПРО ТВЕРДІСТЬ ВОДИ (ПОСТІЙНУ, ТИМЧАСОВУ) І МЕТОДИ ЇЇ УСУНЕННЯ (ЗМЕНШЕННЯ)
ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ
УРОК 6. ПОНЯТТЯ ПРО ТВЕРДІСТЬ ВОДИ (ПОСТІЙНУ, ТИМЧАСОВУ) І МЕТОДИ ЇЇ УСУНЕННЯ (ЗМЕНШЕННЯ)
Цілі: вивчити, що таке твердість води, її види (постійна, тимчасова), методи її усунення (зменшення); розширити знання учнів про сполуки кальцію та магнію, закріпити знання про лужні й лужноземельні метали; закріпити вміння складати рівняння хімічних реакцій, що ілюструють хімічні властивості лужних і лужноземельних металів, методи усунення обох видів твердості води.
Обладнання: ПСХЕ, таблиця “Будова
Тип уроку: вивчення нового матеріалу (додатковий об’єм).
Форми роботи: лекція, бесіда, хімічна розминка, хімічний крос, лабораторний дослід 12, демонстраційний експеримент 13.
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й мети уроку
III. Актуалізація опорних знань
“Хімічна розминка” за основними поняттями
– Лужні метали.
– Положення у ПС.
– Спільне в будові зовнішнього електронного шару.
– Ступінь окиснення у сполуках.
– Лужноземельні метали.
– Положення у ПС.
– Спільне в будові зовнішнього
– Ступінь окиснення у сполуках.
– Спільне й відмінне у фізичних властивостях.
– Спільне в хімічних властивостях.
“Хімічний крос”
Учні працюють біля дошки.
Завдання 1. Виконується під час розминки. Два учні записують будову й електронні формули атомів Натрію та Калію, а також Магнію та Кальцію. У результаті виконання завдання роблять висновок про спільне в будові цих атомів та їх ступені окиснення. При цьому пропонується згадати схеми, складені на попередньому уроці.
Завдання 2. Два учні знову йдуть до дошки й порівнюють хімічні властивості натрію та кальцію. Під час виконання цього завдання учні працюють у зошитах. У результаті роботи роблять висновок про спільне й відмінне в хімічних властивостях цих металів (Кальцій – слабший відновник).
Завдання 3. Виконується одночасно з другим (з метою економії часу).
Два учні порівнюють хімічні властивості калій і кальцій оксидів, складають відповідні рівняння реакцій.
Завдання 4. Два учні порівнюють хімічні властивості натрій і кальцій гідроксидів.
Сильних учнів можна використати для швидкої перевірки виконання завдань і підбиття підсумків розгляду хімічних властивостей лужних і лужноземельних металів та їх сполук.
IV. Мотивація навчальної діяльності
Усім відомо, що мило добре піниться й пере в дощовій воді. А от якщо взяти воду з колодязя або ключову – то погано. Така вода називається жорсткою. Вона непридатна для охолодження двигунів автомобілів і живлення парових котлів, бо утворює накип.
Усі ви бачили всередині чайників накип. Це не дуже естетично на вигляд, вода мутна, пити неприємно. Що ж це за речовина? Звідки вона береться?
Як її усунути? От сьогодні на уроці ми про це дізнаємось.
V. Вивчення нового матеріалу
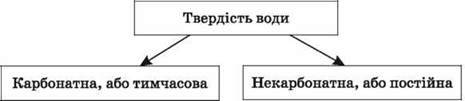
Даємо визначення твердості води, вказуємо її види.
Складання таблиці
Види твердості | Карбонатна, або тимчасова | Некарбонатна, або постійна |
Чим спричинена | Спричиняється наявністю у воді кальцій і магній гідрогенкарбонатів Ca(HCO3)2 і Mg(HCO3)2 | Спричиняється наявністю у воді сульфатів і хлоридів кальцію й магнію CaSO4, MgSO4, CaCl2, MgCl2 |
Методи усунення | 1. Кип’ятіння. 2. Додавання соди. 3. Додавання вапняного молока. Демонстраційний експеримент “Усунення твердості води” | Додавання соди. Лабораторний дослід “Усунення накипу з поверхні побутових приладів” |
Рівняння реакцій |
|
|
VI. Засвоєння одержаних знань
1. Чим викликана твердість води?
2. Які види твердості води вам відомі?
3. Якої шкоди завдає тверда вода?
4. Як можна усунути тимчасову твердість води?
VII. Підбиття підсумків уроку
VIII. Домашнє завдання