Розчини
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.3. Розчини
Розчини – гомогенні (однорідні) суміші з двох, (або кількох) речовин, відносні кількості яких можуть значно змінюватись.
Будь-який розчин складається з розчиненої речовини (речовин) і розчинника, тобто середовища, у якому молекули або йони цієї речовини рівномірно розподілені.
Розчинник – це компонент розчину, агрегатний стан якого при утворенні розчину не змінюється. Якщо змішуються
За агрегатним станом розрізняють тверді (металічні сплави), газоподібні (наприклад, повітря) і рідкі розчини. Найчастіше під словом “розчин” розуміють рідину.
На практиці здебільшого ми маємо справу з водними розчинами, тобто такими, у яких розчинником є вода. У такому разі воду вважають розчинником і тоді, коли її кількість менша за кількість розчиненої в ній речовини: наприклад, говорять
Розчинність речовини S (від лат. solvere – розчиняти) – це здатність речовини розчинятись у розчиннику; визначається кількістю речовини, яка може розчинитись у певній кількості розчинника, утворивши за даної температури насичений розчин.
Розчинність твердих і рідких речовин у воді з підвищенням температури зазвичай суттєво збільшується, хоча трапляються й такі випадки, коли вона зростає незначною мірою (NaCl, АlСl3) або навіть зменшується (Са(ОН)2, Na2SО4, Са(СН3СОО)2). Розчинність газів зростає з підвищенням тиску і зменшується з підвищенням температури.
Зазвичай полярні (ковалентні та йонні) сполуки добре розчиняються в полярних розчинниках, а неполярні сполуки – у неполярних. Наприклад, у воді (Н2O – полярна молекула) добре розчиняються нижчі спирти, альдегіди, карбонові кислоти. їхню високу розчинність пояснюють тим, що функціональні групи молекул цих речовин – гідроксильна – ОН, альдегідна – СНО, карбоксильна – СООН – є полярними (однак зі збільшенням кількості атомів Карбону у відповідних молекулах їхня розчинність зменшується). І навпаки, вуглеводні (неполярні) змішуються один з одним у будь-яких співвідношеннях. У воді такі речовини розчиняються погано або не розчиняються зовсім. Йод І2 (неполярна молекула) у воді не розчиняється зовсім, проте добре розчиняється в органічних розчинниках.
Деякі сполуки мають необмежену розчинність (спирт у водіj сульфатна кислота у воді), а інші розчиняються в обмежених кількостях. Важливою характеристикою розчину є його концентрація.
Концентрацією розчину називають кількість розчиненої речовини в одиниці маси або об’єму розчину1.
Під час розчинення кристала в рідині молекули (або йони) речовини відриваються від кристала і дифундують між молекулами розчинника. Як тільки почалось розчинення, спостерігається і зворотній процес – кристалізація. У міру зростання концентрації розчиненої речовини процес розчинення уповільнюється, а процес кристалізації прискорюється. Коли швидкості обох процесів вирівнюються і встановлюється їхня динамічна рівновага, розчин стає насиченим. Насичений розчин – це розчин, у якому за певної температури дана речовина більше не може розчинятись.
Часто концентрацію насиченого розчину (за певної температури) виражають через масу речовини в 100 г розчинника (зазвичай води) і називають коефіцієнтом розчинності, ks (“ка-ес”). Так, запис 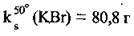 означає, що в 100 г води за температури 50 °С може розчинитись щонайбільше 80,8 г калій броміду.
означає, що в 100 г води за температури 50 °С може розчинитись щонайбільше 80,8 г калій броміду.
Дані про розчинність найвідоміших речовин у воді (у 100 г води за температури 20 °С) зведені в “Таблицю розчинності кислот, основ та солей у воді” (див. Додаток 3). Добре розчинними речовинами (у таблиці позначено літерою “Р”) вважають такі, коефіцієнт розчинності яких більш ніж 10 г, малорозчинними (“М”) – розчинність яких від 10 до 0,01 г, нерозчинними (“Н”) – менш ніж 0,01 г.
За певних умов (наприклад, поступово й обережно охолоджуючи насичений розчин) можна отримати перенасичений розчин2, коли концентрація розчиненої речовини у перенасичених розчинах більша, ніж у насичених. Тривалий час (у спокою) такий розчин може існувати без змін. Але якщо його струснути або внести в нього кристалик розчиненої речовини, т. зв. зерно кристалізації, починається активний процес кристалізації надлишку розчиненої речовини3.
Відповідно ненасичений розчин – це розчин, у якому за певної температури дана речовина ще може розчинятись (зазвичай з ним і мають справу). Зрозуміло, що концентрація розчиненої речовини у ненасичених розчинах менша, ніж у насичених.
Виражати концентрацію можна по-різному. Зручною характеристикою розчину є масова частка w, оскільки за її допомогою можна легко визначати масу розчиненої речовини m у розчині та масу розчину m(р-ну):
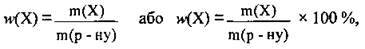
Де w(X) – масова частка розчиненої речовини X,
M(Х) – маса розчиненої речовини X, г,
M(р-ну) – маса розчину, г.
Молярна концентрація показує, яка кількість розчиненої речовини міститься в 1 л розчину:
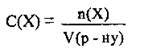
Де С(Х) – молярна концентрація (молярність розчину) речовини Х, моль/л,
N(Х) або v(X) -^- кількість речовини X в розчині, моль,
V(р-ну) – об’єм розчину, л.
Оскільки 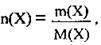 то
то
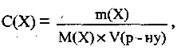
Де С(Х) – молярна концентрація (молярність розчину) речовини X, моль/л,
M(Х) – маса розчиненої речовини X, г,
М(Х) – молярна маса речовини X, г/моль,
V(р-ну) – об’єм розчину, л.
Розчин, у 1 літрі якого міститься 1 моль розчиненої речовини, називають молярним (одно молярним)4. Позначається літерою “М”. Наприклад, запис 1 М (КОН) – одномолярний розчин їдкого калі – означає, що 1 л розчину містить 1 моль речовини КОН, тобто 56 г.
Важливою для розрахунків величиною є густина розчину. Між густиною розчинів та їхнім складом є залежність, яку відображають у графіках, таблицях. Склад розчину певної речовини можна визначити, якщо виміряти його густину. Абсолютну густину розчину ρ (“ро”) визначають відношенням його маси m до об’єму V:
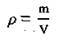
Відносну густину рідких розчинів вимірюють за допомогою ареометрів. Вона означає відношення густини розчину до густини дистильованої води. Густина розчинів залежить від температури (температура вимірювання вказана на кожному ареометрі, градуювання простих ареометрів проводять за температури 20 °С).
_____________________________________________________
1 Історично користуються різними поняттями концентрації розчину, наприклад масовою концентрацією, тобто одиницями маси розчиненої речовини, яка міститься в 100 одиницях маси розчину. У побуті часто використовують поняття об’ємної концентрації, або об’ємного процента (% об.), тобто співвідношення об’ємів розчиненої речовини (рідкої) і розчину. Згідно з правилами IUPAC відношення маси або кількості розчиненої речовини до одиниці об’єму розчину називають концентрацією розчиненої речовини.
2 Відкрив 1784 р. і почав вивчати це явище, увів термін перенасичений розчин російський академік (німецького походження) Йоган Тобіас Ловіц (1757-1804).
3 У побутових хімічних грілках використовують натрій ацетат. Під час нагрівання до 100 °С (зазвичай у посудині з киплячою водою) натрій ацетат тригідрат (температура плавлення – 58 °С) розплавлюється і переходить у водний розчин натрій ацетату. Під час охолодження утворюється його перенасичений розчин, який зберігається за кімнатної температури без утворення твердої фази. Натискання на спеціально вмонтований металевий диск спричиняє утворення центру кристалізації всередині грілки: перенасичений розчин переходить у тверду фазу. Процес кристалізації супроводжується виділенням значної кількості теплоти – близько 264-289 кДж/кг.
4 Відповідно розчин, віл якого міститься 0,1 моль речовини, називають децимолярним, 0,01 моль – сантимолярним, 0,001 – мілімолярним.