Сигма – і пі-зв’язок
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.5. Сигма – і пі-зв’язок
Просторово розрізняють два типи зв’язку – сигма – і пі-зв’язок.
1. Сигма-зв’язок (σ-зв’язок) – простий (одинарний) ковалентний зв’язок, що утворюється перекриванням електронних хмар по лінії, яка з’єднує атоми. Зв’язок характеризується осьовою симетрією:
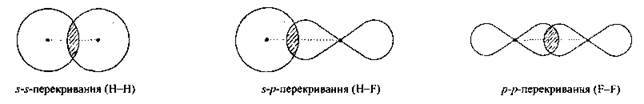
В утворенні σ-зв’язку можуть брати участь як звичайні, так і гібридизовані
2. Пі-зв’язок (π-зв’язок). Якщо в атома після утворення σ-зв’язку залишились неспарені електрони, він може використати їх на утворення другого типу зв’язку, який називають π-зв’язком. Розгляньмо його механізм на прикладі утворення молекули кисню O2.
Електронна формула атома Оксигену – 😯 1s22s22p2, або 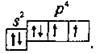
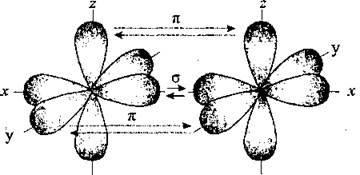
Два неспарені р-електрони в атомі Оксигену можуть утворити дві спільні ковалентні пари з електронами другого атома Оксигену:
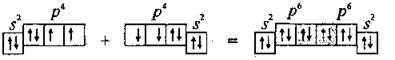
Одна пара йде на утворення σ-зв’язку:

Інша, перпендикулярна
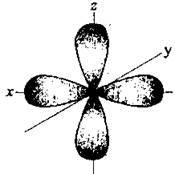
Іще одна p-орбіталь (ру), як і s-орбіталь, на якій містяться по два спарені електрони, участі у зв’язку не беруть і не усуспільнюються.
Аналогічним чином при утворенні органічних сполук (алкенів та алкадієнів) після sp2-гібридизації в кожного з двох атомів Карбону (між якими утворюється зв’язок) залишається по одній негібридизованій р-орбіталі.
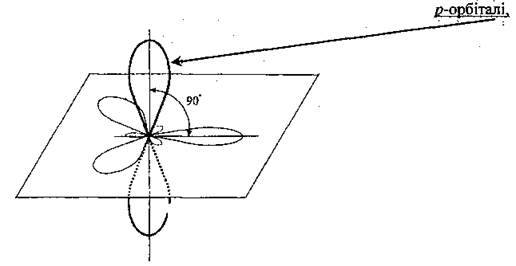
Які розміщуються в площині, що є перпендикулярною до осі з’єднання атомів Карбону:
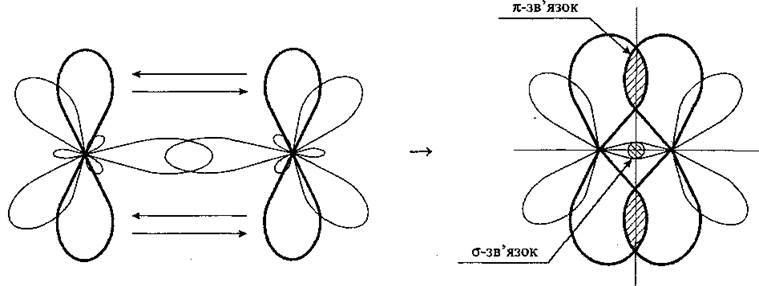
У сумі σ – і π-зв’язки дають подвійний зв’язок.
Потрійний зв’язок утворюється аналогічно і складається з одного σ-зв’язку (рх) та двох я-зв’язків, які утворені двома взаємоперпендикулярними парами p-орбіталей (ру, pz):
Приклад: утворення молекули азоту N2.
Електронна формула атома Нітрогену – 7N 1s22s22p3 або 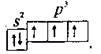 Три p-електрони в атомі Нітрогену є неспареними і можуть утворити три спільні ковалентні пари з електронами другого атома Нітрогену:
Три p-електрони в атомі Нітрогену є неспареними і можуть утворити три спільні ковалентні пари з електронами другого атома Нітрогену:
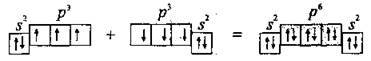
У результаті утворення трьох спільних електронних пар N≡N кожний атом Нітрогену набуває стійку електронну конфігурацію інертного елемента 2s22p6 (октет електронів).
Потрійний зв’язок виникає і при утворенні алкінів (в органічній хімії). У результаті sр-гібридизації зовнішньої електронної оболонки атома Карбону утворюється дві sр-орбіталі, розташовані по осі 0Х. Одна з них іде на формування о-зв’язку з іншим атомом Карбону (друга – на формування σ-зв’язку з атомом Гідрогену). А дві не гібридизовані р-орбіталі (ру, pz) розміщуються перпендикулярно одна до одної та до осі з’єднання атомів (0Х).
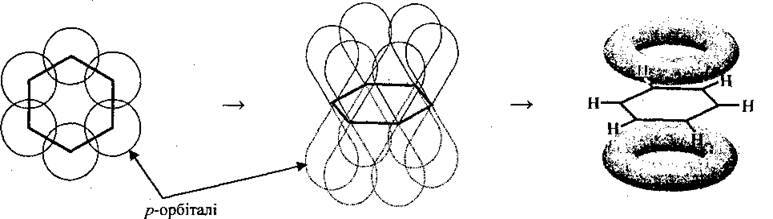
За допомогою π-зв’язку формується молекула бензену та інших аренів. Довжина цього зв’язку (ароматичного, “полуторного”, позначається  )1 є проміжною між довжиною простого (0,154 нм) і подвійного (0,134 нм) зв’язку і становить 0,140 нм. Усі шість атомів Карбону мають спільну π-електронну хмару, густина якої локалізована над і під площиною ароматичного ядра та рівномірно розподілена (делокалізована) між усіма атомами Карбону. За сучасними уявленнями вона має форму тороїда:
)1 є проміжною між довжиною простого (0,154 нм) і подвійного (0,134 нм) зв’язку і становить 0,140 нм. Усі шість атомів Карбону мають спільну π-електронну хмару, густина якої локалізована над і під площиною ароматичного ядра та рівномірно розподілена (делокалізована) між усіма атомами Карбону. За сучасними уявленнями вона має форму тороїда:
______________________________________________________
1 Під довжиною зв’язку розуміють відстань між центрами ядер атомів Карбону, що беруть участь у цьому зв’язку.