Складання рівнянь окисно-відновних реакцій – ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 7. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОЛІЗ
§ 7.3. Складання рівнянь окисно-відновних реакцій
Застосовуються два методи складання рівнянь окисно – відновних реакцій – метод електронного балансу і метод напівреакцій.
Метод електронного балансу. За цим методом порівнюють ступені окиснення атомів у вихідних і кінцевих речовинах, керуючись правилом: число електронів, які віддав відновник, має дорівнювати числу електронів, які приєднав
Приклад 1. Складання рівняння реакції міді з розчином нітрату паладію(ІІ). Запишемо формули вихідних і кінцевих речовин реакції і покажемо зміни ступенів окиснення:
0 +2 +2 0
Сu + Рd(NO3)2 = Сu(NО3)2 + Pd.
Мідь, утворюючи іон купруму, віддає два електрони, її ступінь окиснення підвищується від 0 до +2. Мідь – відновник. Іон паладію, приєднуючи два електрони, змінює ступінь окиснення
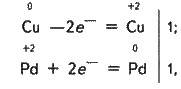
З яких випливає, що коефіцієнти біля окисника і відновника дорівнюють 1. Остаточне рівняння реакції:
Cu + Pd(NO3)2 = Сu(NО3)2 + Pd.
Як бачимо, в сумарному рівнянні реакції електрони не фігурують.
Щоб перевірити правильність складеного рівняння, підрахуємо число атомів кожного елемента в його правій і лівій частинах. Наприклад, у правій частині рівняння 6 атомів оксигену, у лівій – також 6 атомів; паладію – 1 і 1; купруму також 1 і 1. Значить, рівняння складене правильно.
Перепишемо це рівняння в іонній формі:
Cu + Pd2+ + 2NO-3 = Сu2+ + 2NO-3 + Pd.
Після скорочення однакових іонів дістанемо:
Cu + Pd2+ = Cu2+ + Pd.
Приклад 2. Складання рівняння реакції взаємодії оксиду мангану (IV) з концентрованою хлоридною кислотою (за допомогою цієї реакції в лабораторних умовах добувають хлор). Запишемо формули вихідних і кінцевих речовин реакції:
НСl + МnО2 -> Сl2 + МnСl2 + Н2О.
Покажемо зміну ступенів окиснення атомів до і після реакції:
-1 +4 0 +2
НСl + МnОr -> Сl2 + МnСl2 + Н2О.
Ця реакція окисно-відновна, оскільки змінюються ступені окиснення атомів хлору і мангану. НСl – відновник, МnО2 – окисник. Складаємо електронні рівняння:
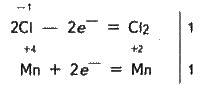
І знаходимо коефіцієнти біля відновника і окисника. Вони відповідно дорівнюють 2 і 1. Коефіцієнт 2 (а не 1) ставиться тому, що два атоми хлору зі ступенями окиснення -1 віддають 2 електрони. Цей коефіцієнт вже стоїть в електронному рівнянні:
2НСl + МnO2 -> Сl2 + МnСl2 + Н2О.
Знаходимо коефіцієнти для інших речовин, що реагують. З електронних рівнянь видно, що на 2 моль НСl припадає 1 моль МnОr. Однак, враховуючи, що для зв’язування двозарядного іона мангану, який утворюється, потрібно ще 2 моль кислоти, перед відновником слід поставити коефіцієнт 4. Тоді води утвориться 2 моль. Остаточне рівняння має вигляд:
4НСl + МnО2 = Сl2 + МnСl2 + 2Н2О.
Перевірку правильності написання рівняння можна обмежити підрахунком числа атомів одного якого-небудь елемента, наприклад хлору: у лівій частині рівняння їх 4 і в правій 2 + 2 = 4.
Оскільки в методі електронного балансу зображуються рівняння реакцій у молекулярній формі, то після складання і перевірки їх треба написати в іонній формі:
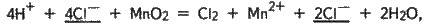
І після скорочення однакових іонів в обох частинах рівняння (вони підкреслені) дістанемо:
4Н+ + 2Сl – + МnО2 = Сl2 + Мn2+ + 2Н2О.
Приклад 3. Складання рівняння реакції взаємодії сірководню з підкисленим розчином перманганату калію.
Напишемо схему реакції – формули вихідних і добутих речовин:
H2S + KMnO4 + H2SO4 −>S + MnSO4 + K2SO4 + Н2О.
Потім, зазначимо зміну ступенів окиснення атомів до і після реакції:
-2 +7 0 +2
H2S + КМnO4 + H2SO4 −> S + MnSO4 + K2SO4 + Н2О.
Змінюються ступені окиснення в атомів сульфуру і мангану (H2S – відновник, КМnO4 – окисник). Складаємо електронні рівняння, тобто зображуємо процеси віддавання і приєднання електронів:
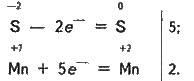
І, нарешті, знаходимо коефіцієнти біля окисника і відновника, а потім біля інших реагуючих речовин. З електронних рівнянь видно, що потрібно взяти 5 моль H2S і 2 моль КМnO4, тоді добудемо 5 моль атомів S і 2 моль MnSO4. Крім того, із зіставлення атомів у лівій і правій частинах рівняння знаходимо, що утворюється також 1 моль K2SO4 і 8 моль води.
Остаточне рівняння реакції матиме вигляд:
5H2S + 2КМnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8Н2О.
Правильність написання рівняння підтверджується підрахунком числа атомів одного елемента, наприклад оксигену; у лівій частині рівняння їх 2 ∙ 4 + 3 ∙ 4 = 20 і в правій 2 ∙ 4 + 4 + 8 = 20.
Переписуємо рівняння в іонній формі:
5H2S + 2MnO4 + 6Н+ = 5S + 2Мn2+ + 8Н2O.
Відомо, що правильно написане рівняння реакції виражає закон збереження маси речовини. Тому число одних і тих самих атомів у вихідних речовинах і в продуктах реакції має бути однаковим. Мають зберігатися і заряди.
Сума зарядів вихідних речовин завжди має дорівнювати сумі зарядів продуктів реакції. Метод напівреакцій, або іонно-електронний метод. Як видно із самої назви, цей метод грунтується на складанні іонних рівнянь для процесу окиснення і процесу відновлення з подальшим складанням загального рівняння. Як приклад складемо рівняння тієї самої реакції, яку використовували при поясненні методу електронного балансу (див. приклад 3). Під час пропускання сірководню H2S крізь підкислений розчин перманганату калію КМnОg малинове забарвлення зникає і розчин мутнішає. Дослід показує, що помутніння розчину спричинене утворенням елементарної сірки внаслідок перебігу такого процесу:
H2S −> S + 2Н+.
Ця схема зрівняна за числом атомів. Для зрівнювання за числом зарядів потрібно від лівої частини схеми відняти два електрони, після чого стрілку можна замінити знаком рівності:
H2S – 2е – = S + 2Н+.
Це перша напівреакція – процес окиснення відновника H2S. Знебарвлення розчину зумовлене переходом іона МnО-, (він має малинове забарвлення) в іон Мn2+ (практично безбарвний і лише за великої концентрації має слабко-рожеве забарвлення), що можна виразити схемою МnО-4 Мn2+.
У кислому розчині оксиген, що входить до складу іонів МnОg, разом з іонами гідрогену утворює воду. Тому процес переходу записуємо так:
МnО-4 + 8Н+ −> Мn2+ + 4Н2О.
Щоб стрілку замінити на знак рівності, треба зрівняти заряди. Оскільки вихідні речовини мають сім позитивних зарядів (7+), а кінцеві – два позитивних (2+), то для дотримання умови збереження зарядів потрібно до лівої частини схеми додати п’ять електронів:
МnО-4 + 8Н+ + 5е – = Мn2+ + 4Н2О.
Це друга напівреакція – процес відновлення окисника, тобто перманганат-іона МnO-4 .
Для складання загального рівняння реакції треба рівняння напівреакцій почленно додати, попередньо зрівнявши числа відданих і приєднаних електронів. У цьому разі за правилами знаходження найменшого кратного визначають відповідні множники рівнянь напівреакцій. Скорочений запис має такий вигляд:
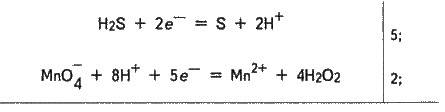
5H2S + 2МnO-4 + 16Н+ = 5S + 10Н+ + 2Mn2+ + 8Н2О.
І, скоротивши на 10Н+, остаточно дістанемо:
5H2S + 2MnO-4 + 6Н+ = 5S + 2Мn2+ + 8Н2О.
Перевіряємо правильність складеного в іонній формі рівняння: число атомів оксигену в лівій частині 8, у правій – 8; число зарядів: у лівій частині (2-) + (6+) = 4+, у правій 2 (2+) = 4+. Рівняння складене правильно, оскільки атоми і заряди зрівняно.
Методом напівреакцій складається рівняння реакцій в іонній формі. Щоб від нього перейти до рівняння реакцій в молекулярній формі, робимо так: у лівій частині іонного рівняння для кожного аніона добираємо відповідний катіон, а для кожного катіона – аніон. Потім ті самі іони в такій самій кількості записуємо в праву частину рівняння, після чого іони об’єднуємо в молекули:
5H2S + 2МnO-4 + 6Н+ = 5S + 2Мn2+ + 8Н2О;
2К + 3SO-4 = 2К+ + 3SO-24;
__________________________________________________
5H2S + 2КМnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8Н2О.
Отже, складання рівнянь окисно-відновних реакцій за методом напівреакцій дає такий самий результат, як і за методом електронного балансу.
Порівняємо обидва методи. Переваги методу напівреакцій порівняно з методом електронного балансу в тому, що в ньому застосовуються не гіпотетичні іони, а ті, що реально існують.
+7 +6 +6+4
Насправді в розчині немає іонів Mn, Cr, S, S, а є іони МnO-4, Сr2-4 , СrO2-4 , SO2-4 , SO2-3 . У методі напівреакцій не треба знати ступені окиснення атомів. Написання окремих іонних рівнянь напівреакцій необхідне для розуміння хімічних процесів у гальванічному елементі і під час електролізу. В цьому методі видно роль середовища як активного учасника всього процесу (див. § 7.4). Нарешті, при використанні методу напівреакцій не обов’язково знати всі речовини, що утворюються, вони з’являються в рівнянні реакції під час його виведення. Тому методу напівреакцій слід віддавати перевагу і застосовувати його під час складання рівнянь усіх окисно – відновних реакцій, що відбуваються у водних розчинах.