Сучасні уявлення про будову атома
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 3. Сучасні уявлення про будову атома
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати основні положення сучасної теорії будови атома, склад атомних ядер;
Пояснювати значення понять “нукліди”, “нуклони”, “ізотопи”, “орбіталь”;
Уміти визначати число протонів і нейтронів у ядрі атома, число електронів у атомі, його масове число.
Упродовж 25 століть, із часів філософів Давньої Греції і до кінця ХІХ ст., у науці
Проте наприкінці ХІХ ст. у фізиці було зроблено низку відкриттів, які засвідчили складну будову атома.
– Пригадайте, які відкриття стали прямими доказами складності атома.
На підставі нових відкриттів почала розвиватися теорія будови атома (модель будови атома Е. Резерфорда, 1911 р.; модель Н. Бора, 1913 р.).
– Поясніть, що є спільним для цих моделей і чим вони різняться одна від одної.
Сучасна теорія будови атома виникла як результат переосмислення й доповнення
Основні положення сучасної теорії будови атома
1. Електрону властива двоїста (корпускулярно-хвильова) природа. Як частинка електрон має певну масу і заряд, а як хвиля – здатність до дифракції (обгинання перешкоди).
2. Для електрона неможливо одночасно й точно виміряти координату та енергію. У кожний момент часу можна визначити лише одну з цих властивостей.
3. Електрон в атомі не обертається навколо ядра за певною траєкторією, а може рухатися в будь-якій частині навколоядерного простору. Однак вірогідність перебування його в різних частинах простору неоднакова.
4. Ядра атомів складаються з протонів і нейтронів. Число протонів дорівнює атомному номеру елемента (протонне число), а сума чисел протонів і нейтронів (нуклонів) відповідає його масовому числу.
Різні види атомів мають загальну назву – нукліди. Найважливіші характеристики нуклідів – атомний номер і масове число, їх позначають зліва від символу елемента, наприклад n Na – нуклід Натрію. Якщо нукліди одного й того самого елемента мають однаковий заряд ядра, але різні масові числа, вони називаються ізотопами. Наприклад, 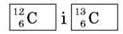 – ізотопи Карбону.
– ізотопи Карбону.
Розрізняють стійкі (стабільні) та нестійкі (радіоактивні) ізотопи. Їх називають і позначають тими самими символами, що й хімічні елементи. Винятком є ізотопи Гідрогену, які мають індивідуальні назви і символи:
Тритій.

Знаючи частки ізотопів у природному елементі та середнє значення їх атомних мас, можна визначити відносну атомну масу елемента у періодичній системі. Загальна формула для розрахунку:
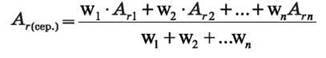
■ Приклад. У природному Хлорі частка нукліда 35Cl становить ≈ 75,53 %о, а нукліда 37Cl ≈ 24,47 % (атомних відсотків). Визначити відносну атомну масу елемента Хлору.
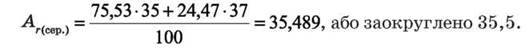
Коротко про головне
Атом – складна частинка. Він складається з позитивно зарядженого ядра і негативно заряджених електронів. Ядро атома містить протони і нейтрони, загальна назва яких – нуклони.
Маса атома зосереджена в його ядрі. Кількість протонів і нейтронів визначає масове число елемента. Кількість протонів у ядрі дорівнює атомному номеру (протонному числу) елемента, а кількість нейтронів – масовому числу мінус атомний номер.
Електрон має корпускулярно-хвильову природу. Кількість електронів у атомі також дорівнює атомному номеру (протонному числу) елемента.
Електрони в атомі постійно рухаються, але певної траєкторії руху вони не мають. Електрон може перебувати в будь-якій ділянці простору біля ядра, утворюючи електронну хмару. Така тривимірна ділянка простору біля ядра, де перебування електрона найімовірніше, називається орбіталлю.