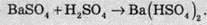Сульфати – ОКСИГЕН. СУЛЬФУР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ОКСИГЕН. СУЛЬФУР
Сульфати
Солі сульфатної кислоти, сульфати, зазвичай являють собою кристалічні речовини, добре розчинні у воді (окрім PbSO4 та BaSO4). Безводні сульфати безбарвні, але деякі їхні сполуки з водою (кристалогідрати) мають колір: NiSO4 ∙ 7Н2O – інтенсивно зелений, FeSO4 ∙ 7Н2O – блідо-зелений, а CuSO4 ∙ 5Н2O – синій. Кристалогідрати сульфатів металів називають купоросами.
Зазвичай сульфати добувають шляхом дії
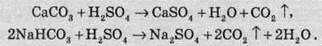
При прожарюванні сульфатів лужних і лужноземельних металів до високих температур розкладу сполуки не відбувається аж до плавлення (близько 2000 °С). При нагріванні сульфатів менш активних металів відбувається розклад на оксиди:
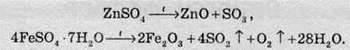
Сульфати металів, що перебувають в електрохімічному ряді потенціалів правіше водню, розкладаються на метал, сульфур оксид та кисень:
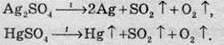
Кристалогідрати подвійних сульфатів, які містять одновалентний і тривалентний катіон, мають назву
Застосування сульфатів у промисловості
Назва сполуки | Формула сполуки | Сфера застосування |
Калій сульфат | K2SO4 | Добриво, виробництво галунів |
Натрій сульфат | Na2SO4 | У целюлозно-паперовій, миловарній промисловості та при виробництві скла |
Амоній сульфат | (NH4)2SO4 | Добриво |
Мідний купорос | CuSO4 ∙ 5H2O | У сільському господарстві, у фотографії, для травлення металів |
Барій сульфат | BaSO4 | У медицині |
Сульфати кальцію – гіпс та алебастр | CaSO4 ∙ 2H2O тa 2CaSO4 ∙ H2O | У будівництві |
Сульфати використовують майже у всіх галузях промисловості.
Якісна реакція на сульфат-іон
В аналітичній хімії використовують реакцію взаємодії хлориду або нітрату Барію із утворенням барій сульфату. При цьому утворюється білий дрібнокристалічний осад, який не розчиняється в кислотах та лугах:
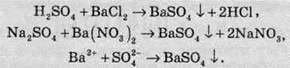
Отриманий осад розчиняється тільки в концентрованій сульфатній кислоті: